治験依頼者の方へ_手順(附属病院)
治験の依頼から開始までの流れ (更新日:2026年1月29日更新) 
公立大学法人横浜市立大学附属病院における標準的な治験の依頼から開始までの流れです。
※当院では、2024年4月IRB審査分より、文書管理システム「Agatha」を利用し治験関連文書の電磁化を開始しました。
IRB審査資料を含む治験関連文書は、Agatha上で交付・受領・保管を行い、IRBへの審査依頼、IRBから病院長への審査結果通知、病院長から治験依頼者及び治験責任医師への指示決定通知をAgatha上で行います。
Agathaをご利用になる方は、以下の資料をご確認ください。
各種手続きに関するマニュアルは、以下の資料をご確認ください。
※治験開始後の対応についても記載しています。
| 手 続 き マニュアル |
治験・製造販売後臨床試験の取扱いについて_Ver2.0_20260129 |
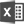 |
|---|---|---|
| ヒアリング・QAシート_Ver2.0_20260129 |
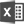 |
1.ご依頼を検討されている方
- ・施設選定調査については、臨床試験管理室 治験事務局までメールでご連絡をお願いいたします。
E-mail:chiken”AT”yokohama-cu.ac.jp ※“AT”を@に置き換えてください - ・IRB申請までの流れなどを確認させていただくと共に、要件・選定調査や申請に係るご質問を受け付けます。
- ・選定にあたり、Web面談を別途調整させていただきます。
- ・事務局との面談前に、医師へ実施の意向を確認してください。
※治験依頼者は、治験責任医師の適格性を判断する際に履歴書を確認しますが、
英語の履歴書や治験分担医師の履歴書が必要である場合には、選定の段階で
治験責任医師にその旨を伝え、了承されてから次の段階の手続きを進めてください。 - ・CRC業務は、院内とSMOのいずれかが対応します。面談後に担当CRCを決定いたします。
- ・SMOにCRC業務を委託する場合、当院との間で「治験等に関する提携基本契約」を締結しているSMOの中から選定し、その費用はSMO費用担当者と直接協議をしてください。
※当院との間で「治験等に関する提携基本契約」を締結しているSMO
株式会社EPLink
シミックヘルスケア・インスティテュート株式会社
ノイエス株式会社
株式会社医療システム研究所 - ・院内CRCがCRC業務を行う場合の費用は、「治験に必要な経費内訳書」の「症例単位(7)CRC人件費」から算出された費用となります。
- ・SMOがCRC業務を行う場合の費用は、「治験に必要な経費内訳」の「症例単位(8)CRC人件費(SMO・CRCの管理監督)」をSMO費用とは別に算出します。
- ・研究経費及び事務局に関わる費用に関する内容確認等は、事務局担当者が対応します。
2. 責任医師との合意
- 治験責任医師と協議し、事前に治験実施について了承(内諾)を得てください。
3. ヒアリングの日程調整、資料準備
原則、初回審査締切日の4週間前までにお願いします。
プロトコル入手後、内容を把握する時間をいただいた後にヒアリングを実施します。
ヒアリングの日程調整は担当CRCが行い、原則、就業時間内に実施します。
- ●必要資料
- プロトコル合意後速やかに、以下の資料を担当CRC宛てにご送付ください。必要部数についても担当CRCにご相談ください。
- ・治験薬及び試験概要を説明するハンドアウト
- ・治験実施計画書
- ・治験薬概要書
- ・同意説明文書(依頼者案)
- ・補償に関する資料
- ・被験者へ配布する資料
- ・被験者への支払いに関する資料
- ・日本語版の各種マニュアル類(治験薬、検査、撮像など)
※上記資料が揃っていない場合、ヒアリングは実施できません。
- ●ヒアリングシート(案)の作成
- 各設問に回答の上、ヒアリング実施日の遅くとも3日前までに、メールで事務局へご提出ください。事務局からヒアリング参加予定者に配信します。
4. ヒアリングの実施
原則、初回審査締切日の2週間前までにお願いします。
- ●目的
プロトコルを理解する場として位置付け、実施する際に問題となる点を確認、その問題の解決方法について議論をする場としてヒアリングを実施します。 - ●方法
依頼者から試験の内容を、CRC、治験事務局、治験薬管理担当者、臨床検査部、放射線部、医事課、看護部等の関係者に説明していただきます。
また、必要に応じて同日又は後日、各担当部署(治験薬管理担当者、臨床検査部等)と業務ごとに個別の打ち合わせをしていただきます。
5. ヒアリング後の対応
- ●ヒアリングシートの更新
各設問について回答が更新されましたら、Excelファイルをヒアリング参加者に随時共有してください。 - ●QAシートの作成
ヒアリング前及びヒアリング時に出た質問とその回答をまとめて入力してください。各質問については、質問者・回答者の入力をお願いします。
すべての回答が固定となりましたら、ヒアリング参加者が内容を確認後、ヒアリングシートを固定します。
固定されたヒアリングシートは、ヒアリングの記録として事務局で保管し、臨床試験管理室で使用します。
- ●初回審査に必要となる書類の作成、提出
各申請書類は統一書式及び院内書式をご利用ください。申請書類案は、提出前に必ず事務局の確認を受けてください。
IRB申請締切りまでに申請書類及び審査対象資料(書式3の添付資料)を、Agathaへアップロードの上、承認依頼を行ってください。
申請締切日は、院内IRBの場合、開催日の約3週間前です。
6. IRB審査
院内IRBの場合、毎月第3火曜日に実施適否の審議を行います。
- 初回審査時、院内IRBでは治験責任医師もしくは分担医師が治験の概要を説明します。依頼者のIRB参加及び説明は不要です。
IRBで説明される内容については、治験責任医師と事前にご準備ください。
7. 受け入れの可否
審議結果の速報は事務局よりご連絡しますが、正式には書式5「治験審査結果通知書」の病院長指示決定通知書の発行をもってお知らせします。
書式5「治験審査結果通知書」の病院長指示決定通知書発行日は、原則IRBの翌日となります。
- 「修正の上で承認」となった場合、下記資料の作成・提出をお願いいたします。
- ・書式6「治験実施計画書等修正報告書」
- ・添付資料:IRBからの指摘を反映した資料
- ※同意説明文書の修正の場合、修正された同意説明文書及び変更対比表を添付資料として提出
- IRBの議事録概要は、当院の臨床試験管理室ホームページで公表します。
https://www-user.yokohama-cu.ac.jp/~ynext/trial/irb_gijiroku/
8. 契約締結
- ●治験実施に係る契約について
治験依頼者と当院との契約については、原則として、当院の『治験契約書(YF書式001) 』を使ってください。また、『治験契約書』の記載内容を変更したい場合には、『治験契約書』を直接書き換えずに、当院の『変更契約覚書(YF書式003)
』を使ってください。また、『治験契約書』の記載内容を変更したい場合には、『治験契約書』を直接書き換えずに、当院の『変更契約覚書(YF書式003) 』を使って変更前後を明確化してください。
』を使って変更前後を明確化してください。
この他に、試験横断的な契約(基本契約)を交わした上で、試験特有のことを別途契約(個別契約)することも可能です。この場合のひな形も用意しておりますので、適宜ご利用ください。
基本契約書と個別契約書のひな形は以下のURLからダウンロードしてください。
『治験委受託基本契約書 』、『治験委託個別契約書
』、『治験委託個別契約書  』
』
基本契約書(ひな形)又は個別契約書(ひな形)の内容を変更したい場合は、『変更契約覚書(YF書式003)』を使わずに、それぞれ直接書き換えて結構です。ただし、契約内容をご相談いただく際に変更履歴を付けてご提示ください。なお、基本契約又は個別契約を締結した後に契約内容を変更する場合には、『変更契約覚書(YF書式003) 』を流用してご使用ください。
』を流用してご使用ください。 - ●CROに業務委託する場合の契約について
原則として、『治験契約書』に加えて、当院の『業務委受託に関する覚書(YF書式002) 』により治験依頼者とCRO、当院の三者による覚書を交わしてください。
』により治験依頼者とCRO、当院の三者による覚書を交わしてください。 - ●SMOに業務委託する場合の契約について
当院とSMOとの間で『業務委受託契約書(YF書式060) 』により契約を締結します。その上で、『治験に関する経費覚書(YF書式061)
』により契約を締結します。その上で、『治験に関する経費覚書(YF書式061) 』により治験依頼者とSMO、当院の三者による覚書を交わしてください。
』により治験依頼者とSMO、当院の三者による覚書を交わしてください。 - ●契約時期について
IRB審査に先立って、契約内容に双方合意の上で治験依頼者の押印済みの契約書を送付いただけた場合、原則として、IRB開催日の翌営業日に契約締結となります。ただし、IRB審査結果が「修正の上で承認」となった場合は、『治験実施計画書等修正報告書(書式6)』の病院長通知日をもって、契約締結日となります。 - ●治験責任医師の署名等について
当院の契約書類には治験責任医師の署名もしくは記名押印が必要ですが、治験事務局で対応しますので、契約書類を当院へ送付される際は空欄で結構です。 - ●締結済み契約書類の送付について
契約書類に当院が押印しましたら5日間程度で、契約書類とともに『治験に必要な経費内訳書(YC書式502)』に記載される[契約単位合計額]に係る請求書を送付しますので、当院が指定する銀行口座へ納付期限(請求書に記載)までにお振り込みください。
9. 治験薬等の搬入
契約が締結しましたら、治験薬(機器・製品)、物品等の搬入ができます。CRAの立ち会いは不要です。
搬入時期については、事前に治験薬担当者及び担当CRCとご調整ください。
10. キックオフミーティング、医局説明会の開催
- ●キックオフミーティング
契約後治験実施前までに、試験実施手順や業務及び当該治験に関する費用等最終確認をします。
参加者:依頼者、治験担当医師、CRC 、治験薬管理者担当者、臨床検査部担当者、医事課、看護師等 - ●医局説明会
原則キックオフミーティングの後、診療科または医局で、具体的な確認と調整を行います。
参加者:依頼者、治験担当医師、CRC、看護師等 - ※キックオフミーティングにおいて、全治験担当医師を含む関係者の最終確認が完了した場合には、医局説明会を開催しないことがあります。
- ※治験担当医師又はCRC等のInvestigator Meeting参加手続き
治験担当医師又はCRC等が、依頼者が開催する参加施設全体の説明会等に参加する場合、依頼者からの派遣依頼文書の要不要、及びかかる費用については、医師は各医局へ、SMO-CRCは各所属する会社へ直接お問い合わせください。 - 依頼文書の提出先
- ・治験担当医師:治験責任医師
- ・治験薬管理者:薬剤部
- ・院内CRC:臨床試験管理室
- ・その他医療従事者:各所属長
- ・SMO-CRC:SMO