最新情報 09.01.19
09.01.19
廣瀬智威助教らが、aPKCλをマウスの腎糸球体のポドサイトでのみ欠失させると腎糸球体変性疾患(巣状糸球体硬化症)を発症する事を見いだしました。
さらに様々な実験から、aPKC-PARはスリット膜の構造タンパク質、Nephrinに直接結合し、その維持に関わっていることを見いだしました。細胞極性の制御遺伝子(分子)が動物個体レベルで腎機能の要として働いていることを示したものです。その結果はPLoS ONEに発表されました。
PLoS ONE 4(1): e4194, 2009.
An Essential Role of the Universal Polarity Protein, aPKCλ, on the Maintenance of Podocyte Slit Diaphragms.
 我が国では糖尿病などの様々な原疾患に由来する慢性腎不全の患者が約28万人おり、その治療としての腎臓透析の費用は年間1兆3千億円に達して医療経済を圧迫する大きな要因となっています。さらにその患者数は毎年1万人ずつ増加しています。この慢性腎不全の80%は腎糸球体変性疾患ですが、腎糸球体の変性機構については未だにほとんど不明です。様々な原因でスリット膜の変性が起きますが、今回その維持機構の一端が明らかになったことになります。今後このマウスモデルを用いて、巣状糸球体硬化症の発症過程をさらに詳細に調べることも可能となりました。これらの成果は、糸球体変性疾患の新しい診断法の開発に直結するばかりでなく、新しい治療法の開発につながる可能性があります。
我が国では糖尿病などの様々な原疾患に由来する慢性腎不全の患者が約28万人おり、その治療としての腎臓透析の費用は年間1兆3千億円に達して医療経済を圧迫する大きな要因となっています。さらにその患者数は毎年1万人ずつ増加しています。この慢性腎不全の80%は腎糸球体変性疾患ですが、腎糸球体の変性機構については未だにほとんど不明です。様々な原因でスリット膜の変性が起きますが、今回その維持機構の一端が明らかになったことになります。今後このマウスモデルを用いて、巣状糸球体硬化症の発症過程をさらに詳細に調べることも可能となりました。これらの成果は、糸球体変性疾患の新しい診断法の開発に直結するばかりでなく、新しい治療法の開発につながる可能性があります。
[研究の概要]
当教室ではこれまでに、線虫の受精卵の極性を決定している分子(細胞極性遺伝子群、aPKC-PAR系)が、生体の構築と機能などに関わる様々な局面で、生命にとって根源的に重要な役割を果たしていることを世界に先駆けて明らかにしてきました。例えば、aPKC-PAR系は生体組織を覆っている上皮細胞の細胞間接着装置の形成と維持を介して、細胞集団の組織化に重要な役割を果たしています。 腎臓の血液ろ過機能の要は、ポドサイト(たこ足細胞)と呼ばれる特殊な細胞の間にできた「すのこ状」の特殊な膜、「スリット膜」です。スリット膜がどのようにして血液をろ過しているのかに関しては、「すのこ」をきちんと配列させる機構があることは知られていましたが、その実体は不明でした。廣瀬智威助教らは、スリット膜が特殊な細胞間接着装置である点に着目しました。 今回、細胞極性遺伝子aPKCλを腎糸球体のポドサイトでのみ欠失させたマウスを作成したところ、一端形成されたスリット膜が徐々に変性し、最終的に巣状糸球体硬化症を呈して死に至ることを見いだしました。
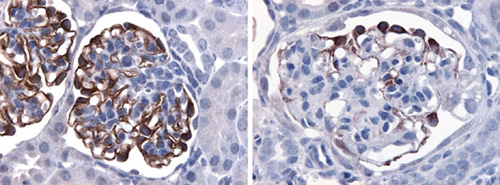
図は生後21日目にスリット膜の主成分であるネフリンタンパク質を検出してスリット膜を見たもの。コントロールマウスの糸球体の境界でボーマン嚢(のう)に面した部分全体を覆っているスリット膜(左)が、aPKCλ遺伝子破壊により部分的に消失している(右)。
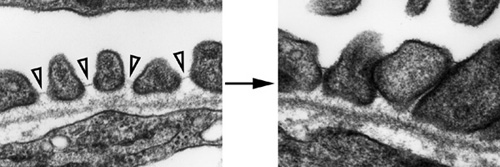
図は電子顕微鏡による観察像。aPKCλ遺伝子破壊により、糸球体たこあし細胞の「あし」の間隙に存在するスリット膜(細い線)(左、矢尻)が消失し、たこあし細胞の「あし」同士が癒合している(右)。 さらに、試験管内で培養した腎糸球体や培養細胞を用いた実験から、細胞極性aPKC-PAR系がスリット膜の「すのこ」の材料となるネフリン分子に直接作用して、スリット膜を維持しておく段階に関わっていることを見いだしました。スリット膜は壊されて作られてというサイクルを回っていますが、細胞極性の制御系は、このいずれかの段階に関わっていることが予測されるに至りました。その具体的な機構の解析が、次の大きな課題となります。
大野茂男 (ohnos@med.yokohama-cu.ac.jp)
〒236-0004 横浜市金沢区福浦 3-9
Copyright (C) 2009 Department of Molecular Biology Ohno Lab. All Rights Reserved.