研究の概要
細胞の運命と機能を調節する仕組み(細胞シグナリング)の解明から、疾患の原因の解明へ
 基本的な問題意識
基本的な問題意識
私たちのからだは、どうしてこんなにうまくできて、機能しているのか?
からだの仕組みを知れば知るほどその精妙さに圧倒される。しかし、私たちが知っているのは、そのごく一部にすぎない。まだまだ隠された秘密があるに違いない!
がんの制圧に向けて私たちに何ができるのか?
現在の死因の1/3はがんで、今後さらに増える。がんは多様で多彩であるので、各々のがんの性質を理解する事が大切である。各々の性質を理解することにより、それを踏まえた合理的な対処法を確立することが現実の課題となる。
成因不明の疾患に対して、私たちに何ができるのか?
多くの疾患は、未だにその原因は不明である。それらを理解する事により、正確な診断と合理的な対処法を確立することが現実の課題となる。
 具体的な問題意識(私たちの独自の視点)
具体的な問題意識(私たちの独自の視点)
細胞は日々死んでいくのに組織や臓器は機能を果たしつつ維持されている。その実態は?そのメカニズムは?
幹細胞やがん幹細胞の大切な性質のひとつは自己複製と分化である。その実態は?メカニズムは?
伝子やその発現過程に起きる様々な傷害に対する防御機構の存在である。その実体は?メカニズムは?
 具体的な研究テーマ(私たちの独自のテーマ)
具体的な研究テーマ(私たちの独自のテーマ)
1)細胞の極性制御(特に上皮細胞の極性と運命決定)の分子機構
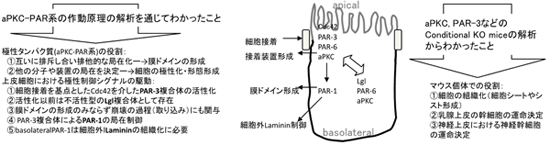
がん抑制遺伝子ASPP2はPAR複合体を介して極性を制御する
Hippo系の活性制御因子KIBRAはaPKCのキナーゼ活性を阻害してアピカル膜ドメインのエキソサイトーシスを抑制する
aPKCは腎糸球体podocyteのスリット膜の維持に必要である(巣状糸球体硬化症のモデル)
進行中の研究課題
幹細胞の自己複製の分子機構、細胞の極性制御機構との関わり
幹細胞の自己複製と細胞の分化・細胞死・老化との関わり、細胞の極性制御機構との関わり
腎糸球体ポドサイトの機能維持の機構、細胞の極性制御機構との関わり
aPKC-PAR系と運命決定のシグナル経路との関わり(臓器の大きさを決めるHippo系との関わり)
aPKC-PAR系と運命決定のシグナル経路との関わり(細胞死の主役p53系との関わり)
脊椎動物の初期発生における役割
腎糸球体podocyteのスリット膜の維持の分子機構
2)がんの発生、悪性化(がん幹細胞、転移)の分子機構
これまでの研究
aPKC-PAR系とがん抑制遺伝子(Lgl, ASPP2)は、直接相互作用している。
aPKCの発現は、様々ながん(乳がん、胃がん、前立腺がん)の悪性化と相関する。
前立腺がんの転移に関わるaPKC-IL6 axis(aPKC-IL6 枢軸)
進行中の研究課題
極性遺伝子(aPKC-PAR系)とがんの悪性化の分子機構
がん抑制遺伝子Lglの作用機構
がん抑制遺伝子ASPP2の作用機構
胃がんの悪性化の分子機構
子宮頸がんの発生の分子機構
3)遺伝子発現過程の傷害に対する防御系(特にmRNA品質監視系)の分子機構
これまでの研究
mRNAサーベイランス系の分子機構
mRNAサーベイランス系の抑制により、遺伝子疾患の薬による症状改善の可能性を細胞レベルで提示
mRNAサーベイランス系の抑制が、がんの抑制に利用できる可能性を提示
進行中の研究課題
mRNAサーベイランス系の要の分子群の構造解析
遺伝性疾患におけるmRNAサーベイランス系の役割、遺伝性疾患の症状改善に向けたアプローチ
がんにおけるmRNAサーベイランス系の役割、全く新しい原理にもとずく制癌剤の開発
![]() 私たちの戦略と方法論
私たちの戦略と方法論
遺伝子と分子のレベルで、細胞の基本的な機能を理解する。
それを踏まえて、細胞推移団が構成する組織・臓器の役割とその破綻である疾患を考える。
遺伝子・分子レベルでの理解(生化学、分子生物学) → 細胞レベルでの理解(上皮培養細胞) → 組織・個体レベルでの理解(ノックアウトマウス) → 疾患との関わり(臨床検体)
一流の研究者、臨床家とのコラボレーション
線虫の遺伝学:内外の専門家(Cornel大Kemphues博士ら、Wisconsin大Anderson博士ら)
マウスの遺伝子操作:内外の専門家(癌研究所、野田哲生博士ら)とのコラボレーション
組織幹細胞の解析:臓器再生教室(谷口英樹博士ら)とのコラボレーション
プロテオミクス解析:プロテオミクス研究室(平野久博士ら)とのコラボレーション
疾患との関わり:病理学教室(長嶋洋二博士ら)とのコラボレーション
疾患との関わり:泌尿器科学、消化器外科学、産婦人科学教室などとのコラボレーション
薬開発:企業とのコラボレーション
大野茂男 (ohnos@med.yokohama-cu.ac.jp)
〒236-0004 横浜市金沢区福浦 3-9
Copyright (C) 2009 Department of Molecular Biology Ohno Lab. All Rights Reserved.
