「免疫疾患」領域
「免疫系転写因子群の翻訳後修飾と機能解析」田村 智彦
1.研究の背景と目的
本研究課題「免疫系転写因子群の翻訳後修飾と機能解析を基盤とした自己免疫疾患およびがんの病態解明と治療法開発」は免疫系の転写因子に注目し、翻訳後修飾の解析やプロテオミクスの観点から自己免疫疾患やがんの病態を理解し、それに基づいた新規治療薬の開発を行うものである。平成23年度から協働機関とともに本プロジェクトでの研究を開始した。
免疫は感染症やがんに対する生体防御に必須である。一方、過剰に働くと自己免疫疾患やアレルギーといった疾患を生むこともある。これまで十数年にわたり転写因子による免疫細胞の分化・機能の制御とその分子機構について研究してきた。中でも転写因子ファミリーInterferon Regulatory Factor(IRF;哺乳動物ではIRF1~9が存在)は元々I型インターフェロン(IFN)系の制御因子として同定されたが、現在ではIFN系を超えて、免疫とがん抑制という生体防御の2つの大きな柱の両者において重要な役割を果たすことが明らかになっている(TamuraらAnnu Rev Immunol,535:584,2008)。そこで本研究では本拠点の高度な解析技術を用いて、転写因子特にIRFの作用機序の理解を通じ自己免疫疾患やがんの病態を理解するとともに、転写因子の発現や機能の制御による新たな治療法の開発を行う。
2.主な研究成果
自己免疫疾患については質量分析やαスクリーンによる関連転写因子のPTMとその責任酵素の同定や、化合物スクリーニングのための転写因子機能モニター細胞樹立を行ったが、本稿では慢性骨髄性白血病(Chronic Myeloid Leukemia;CML)に対する創薬標的としての転写因子IRF8について、樹状細胞(dendritic cells; DC)分化や機能の観点で行った研究成果(WatanabeらCancer Res,73:6642-6653,2013)について述べる。
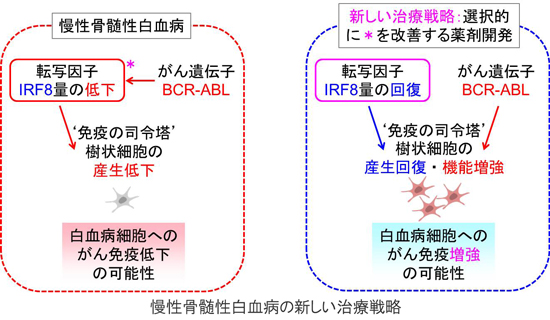
CMLは成人白血病の十数%を占め、9番と22番の染色体転座によって生じるBCR-ABL融合遺伝子から恒常的チロシンリン酸化酵素活性をもつ210 kDaのBCR-ABLが産生されることが病因である。好中球増加や脾腫を特徴とする数年の慢性期を経て、無治療の場合は未熟な芽球が増加する致死的な急性転化を生じる。近年、BCR-ABLに対する分子標的治療薬のチロシンリン酸化酵素阻害剤(tyrosine kinase inhibitors;TKI)の開発により、CML患者の予後は劇的に改善した。しかし、TKIに抵抗性のBCR-ABL変異体(特にT315I)の出現や、TKIは白血病幹細胞に対して作用しにくいため内服を中止すると高率に再発するなどの問題点がある。また、本来CMLは抗腫瘍免疫に対して感受性が高いが、TKI自体が抗腫瘍免疫に重要であるT細胞やDCの機能を抑制するという問題もある。以上の理由からCMLに対する新規治療法の開発が望まれている。
IRF8は免疫細胞の分化や機能を制御する血球系特異的転写因子である。これまでにIRF8がマウスのDCや単球などの分化に必須である一方、ミエロイド細胞の増殖や好中球の分化を抑制することを示してきた(YamamotoらPLoS One,6:e25812,2011;KurotakiらBlood,121:1839-1849,2013)。Irf8欠損マウスは単球やDCの分化障害による免疫不全状態と、好中球増加、脾腫や急性転化などCML様病態の両方を呈する。ヒトにおいても原発性免疫不全症の原因の一つにIRF8遺伝子の変異が知られ、また、CML患者ではIRF8の発現量が著しく減少している。さらに興味深いことには、CML患者におけるDC数の減少が報告されている。以上の知見より、IRF8とCMLは拮抗関係にあると考えられるが、DCという面からの解析はいまだなされていない。そこで本研究では、IRF8とDCという観点でCML病態を理解し、治療標的としてのIRF8の可能性を評価するための解析を行った。
1) CMLモデルマウスにおけるDC分化不全とIRF8発現抑制
BCR-ABLを遺伝子導入したマウス造血幹細胞を放射線照射後のマウスに移入しCMLモデルマウスを作製したところ、脾腫と好中球の増加が予測通り観察されたのに加えて、DC分化が前駆細胞の段階で障害されDC数が著しく減少していることが見いだされた。また、CMLモデルマウス由来細胞ではIRF8の発現が強く抑制されていることが確認された。
2) CMLにおけるDC分化障害とIRF8発現低下の因果関係
マウス骨髄から造血前駆細胞を分離しBCR-ABLを遺伝子導入し、DCへと分化誘導する試験管内DC分化系を用いて解析した。BCR-ABL導入によってDC分化とIRF8発現が著明に阻害されたが、IRF8の強制発現によりT315I変異体を含めたBCR-ABLによるDC分化障害が回復することを見いだした。BCR-ABLのリン酸化酵素活性はIRF8によって抑制されてはいなかった。
3) IRF8で救済したBCR-ABL陽性DCの機能解析
遺伝子発現プロファイリングにより、IRF8の共発現によって分化不全から救済されたBCR-ABL陽性DCは高い機能性をもつことが予測された。実際、IRF8で救済されたDCはサイトカイン産生能、細胞障害性T細胞誘導能ともに、通常のDCよりもむしろ高いことが明らかになった。
4) TKI等のIRF8発現やDC分化に対する効果
複数のTKI(イマチニブ, ニロチニブ, ダサチニブ)、HDAC阻害剤、DNAメチル化阻害剤やSTAT5阻害剤のうち、イマチニブやニロチニブは不完全ながらIRF8の発現を部分的に回復させDCの分化も部分的に救済した。しかし、イマニチブによって分化が救済されたDCではその機能が正常DCに比べて低下していた。また、IRF8によって分化を救済したBCR-ABL発現DCをイマニチブ処理すると、サイトカイン産生能、細胞障害性T細胞誘導能の増強が消失した。
CMLによるDC分化障害の原因はBCR-ABLによるIRF8の発現抑制であることが明らかとなった。IRF8で分化を救済すれば、BCR-ABLはむしろDC機能を高める作用を発揮する。IRF8の機能や発現を選択的に回復させる新規薬剤が開発できれば、細胞増殖や好中球へ偏寄した分化の抑制に加えて、DCの分化が回復し機能が増強されることで抗腫瘍免疫が発動する、次世代CML治療法と繋がる可能性がある。
3.今後の研究方針
対象疾患一つ以上について新規治療薬開発のための化合物スクリーニング、リード化合物の改良、前臨床試験までを目指す。転写因子の発現や機能の制御機構の詳細を明らかにして薬剤の直接標的を定めて行う創薬と、転写因子の発現や機能のモニター法を確立し広く化合物をスクリーニングして行う創薬を並行して進める。当初の計画を前倒しして、すでに一疾患について転写因子機能評価スクリーニング系を確立したので、協働機関と化合物スクリーニングを開始する。
「HIV蛋白質の翻訳後修飾を基盤とした新しい抗エイズ薬の開発」梁 明秀
1.研究の背景と目的
エイズの病原ウイルスであるヒト免疫不全症ウイルス(Human Immunodeficiency Virus:HIV)の感染者は世界中で3千万人を越えており、毎年ほぼ250万人が新たに感染している。多剤併用療法の出現によりウイルス複製をある程度制御することが可能になったが、一方でその長期服用による副作用や薬剤耐性株の出現等が大きな問題となっている。このため、新規作用機序をもつ抗HIV-1薬の開発は、重要かつ緊急の社会的要請である。宿主因子によるHIV-1蛋白質の翻訳後修飾は、ウイルス複製の各ステップにおいてきわめて重要な役割を果たすことが示唆されているが、その詳細な分子機構についてはいまだ不明である。本研究では、無細胞蛋白質合成系とアルファスクリーンを融合した新規の蛋白質相互作用アッセイ系を構築し、上記の翻訳後修飾に関連する因子の同定およびウイルス複製や病原性発現との関連について考察し、宿主因子-ウイルス相互作用を標的とした新規HIV-1/AIDS治療薬の開発を目指す。また、これまでに独自に開発したヒト人工がん幹細胞モデルを活用したプロテオーム解析を実施することで、新たな高精度のがん診断法や革新的治療法の創出を目指す。さらには、蛋白質翻訳後修飾を基盤とした新規のB型肝炎治療薬の開発を行う。
2.主な研究成果
1) Pin1プロテオミクスを活用した新規前立腺がんバイオマーカーの探索
大鵬薬品工業と共に前立腺がんにおけるリン酸化蛋白質の探索研究を実施した。前立腺がん細胞株および正常前立腺組織より可溶性蛋白質を抽出し、リン酸化部位結合酵素であるペプチジルプロリルシストランスイソメラーゼ(Pin1)と特異的に結合する蛋白質をプロテオーム解析した。前立腺がん細胞を試料とした場合にはPin1と結合する蛋白質として分離されるが、正常前立腺細胞には存在しない蛋白質が見いだされた。この蛋白質をゲル内で消化し、ESI-Q/TOFMS解析を行ったところ、TFG(TRK-fused gene産物)であることが同定された。このTFGを中心に機能解析を行った。まず、TFGの遺伝子および蛋白質発現を、疾患検体を用いて系統的に解析したところ、TFGは正常前立腺上皮細胞(前立腺肥大、前立腺炎)と比較して前立腺がん細胞において顕著に発現が亢進していた。また、その発現パターンは、腫瘍腺管を構成する上皮細胞においてCD133陽性のがん幹細胞分画において顕著に認められた。TFGのPin1結合部位におけるリン酸化抗体を作製し、そのリン酸化パターンを検討したところ、前立腺がん細胞株および患者由来の前立腺がん組織において特異的にリン酸化が亢進していた。また、TFGの新たな機能としてアンドロゲン受容体(Androgen receptor: AR)と相互作用し、アンドロゲン非依存的にARを核内で活性化されることを見いだした。ARは前立腺がんの形成や維持に重要な役割を果たすことが知られているが、予後不良や悪性度の高いがんにおいては、アンドロゲン非依存的にARが活性化されることが知られている。今回の発見は、TFGがアンドロゲン非存在下においてARを恒常的に活性化されることを示した最初の報告でありその生物学的・病態学的意義も大きい。また、TFGを分子標的とした新たな抗がん剤の開発が期待できる。
2) 無細胞蛋白質合成系を用いたエイズウイルスおよびB型肝炎ウイルス複製阻害剤の開発(協働機関:セルフリーサイエンス)
これまで本拠点ではセルフリーサイエンスと共同で、合成が難しいとされていたHIVをはじめとする種々のウイルス感染症関連蛋白質の合成、各種解析用高品質モノクローナル抗体作製法の開発、さらに様々な相互作用因子をスクリーニングするためのアッセイ系構築から解析、阻害剤スクリーニングに成果を挙げてきた。具体的には共同開発したレトロウイルス感染阻害薬の効率的なスクリーニング法、および内在性抗レトロウイルス因子APOBEC3G (以下A3G)の活性化に伴うウイルス感染阻害薬の探索を実施した。その結果、A3Gの抗ウイルス活性を促進し、HIV複製を効果的に抑制する化合物群を見いだした。これらのレトロウイルス感染阻害候補化合物は、ウイルス遺伝子の耐性変異に左右されない新たな抗HIV薬を提供することが可能であり、新規創薬に向けた研究開発の加速化が期待できる。
また、本拠点においてHIV-1創薬研究のノウハウを活用し、B型肝炎ウイルスの複製阻害剤の開発や疾患関連蛋白質の翻訳後修飾を司る責任酵素の迅速同定法の開発などの研究を実施した。B型肝炎ウイルスは世界中で20億人が感染しており、毎年60万人がB型肝炎による肝硬変や肝がんで死亡する。現在、使用されているヌクレオシド誘導体に対しては耐性ウイルスが出現しており、新たな薬剤の開発が急務となっている。セルフリーサイエンスとの共同研究により、コムギ無細胞蛋白質合成系を活用した新たな抗HBV薬剤アッセイ系の構築に成功した。これらにより HBV逆転写酵素阻害剤スクリーニングやHBVの侵入阻害剤スクリーニングが簡便かつ迅速に実施できるようになった。本アッセイ系を用いて、国立感染症研究所と共同でHBVの細胞への侵入を阻害する薬剤のスクリーニングを実施した。その結果、HBVの侵入を阻害する優れた治療効果を示す3つの化合物を選別した。今後、本拠点において上記研究成果の実用化に向けた創薬開発研究をさらに加速させたい。
本拠点では、これまでセルフリーサイエンスの協力を得て無細胞蛋白質合成系の構築とその利用を目指した研究部門の設置を進めてきたが、同社が本格的に拠点形成事業に参入したことで、無細胞蛋白質合成技術を基盤とする拠点形成が加速度的に進展すると考えられる。本拠点における具体的な研究支援として、全長ヒトcDNAライブラリーの維持・供与、蛋白質の合成・精製、in vitroアッセイ系の構築等の研究支援、疾患関連蛋白質の翻訳後修飾を司る責任酵素の同定解析などが挙げられる。
3) ヒト人工がん幹細胞モデルを活用したがん幹細胞における翻訳後修飾異常の検出と抗がん幹細胞活性を有する物質の探索
3)-1 人工がん幹細胞モデルを用いた薬剤スクリーニングシステムの確立
これまでに独自に樹立・構築した人工がん幹細胞モデル(iCSC)を用いてがん幹細胞の特性(自己複製能、未分化維持能、腫瘍形成能)を阻害する化合物のスクリーニングを行った。植物天然物由来の化合物119種類を使用した。1次スクリーニングとしてiCSCに化合物を添加し、24時間後にMTTアッセイを行うことにより、15種類の細胞増殖を阻害する化合物が得られた。2次スクリーニングとしては、悪性度の高いヒト乳がん細胞株MBA-MD231をアッセイ系に加え、濃度依存的に細胞増殖を阻害する化合物を4種類見いだした。このうち、最も顕著に細胞増殖を阻害した化合物Aについて検討を行った。まず、TUNEL染色およびCleaved-PARP抗体を用いたウエスタンブロットにより、化合物Aを添加したiCSCにおいてアポトーシスが誘導されることを確認した。また、Tumor sphere assayを行い、1.5μMの化合物A添加により自己複製能が抑制されることがわかった。また、化合物Aを添加した細胞は細胞の形態が神経系細胞様に変化し、β3-Tubulin抗体を用いて免疫染色で陽性像を示した。CD24/CD44マーカーを用いたFACS解析では、未分化細胞の減少が見られた。また、化合物A添加後、3日間培養した細胞をヌードマウスの皮下に移植したところ、何も加えていないコントロール細胞では腫瘍が形成されたのに対して、化合物A添加細胞では腫瘍が形成されなかった。これらの結果から化合物Aはがん幹細胞の腫瘍原性と未分化性を阻止する活性をもつと考えられる。
3)-2 人工がん幹細胞を抗原としたモノクローナル抗体の活用
がん幹細胞を抗原としたモノクローナル抗体を作製するため、WKAH/Hkmラット(雌)の腹腔にiCSCを3回投与後、脾細胞とミエローマ細胞を融合させることで自律増殖能をもったハイブリドーマを作製し、目的の特異性をもつ抗体を産生しているクローンをHAT培地で2週間培養することで選別した。iCSC, ヒト乳がん細胞株(MCF7, T-47D)、正常ヒト乳性上皮細胞を使用してフローサイトメータにてスクリーニングを実施したところ、iCSC特異的な反応を呈示する2種類のハイブリドーマクローンを確認した。続いて、セルフリーサイエンスのプロテインアレイ(約25,000蛋白質)を用いて抗原蛋白質の同定を試みた。その結果、標的蛋白質の候補としてチロシンキナーゼABL1が同定された。ABL阻害薬であるイマチニブをiCSCに投与したところ、細胞の自己増殖能の阻害が認められた。ABLに対するsiRNA処理にてがん幹細胞自己複製能と未分化能が阻害された。ABLの基質となるStat3の阻害剤を用いた検討により、ABL1阻害剤と同様な細胞増殖抑制が認められたことから、ABL1-Stat3アクシスががん幹細胞の維持や増殖に重要な役割を果たすことが示唆された。
3.今後の研究方針
本研究は、エイズ、B型肝炎およびがん幹細胞に対する新規の創薬標的に対する新薬候補化合物の創出を目指している。過去5年間には数万を超える化合物の中から生物機能制御活性を有するヒット化合物を迅速に見いだすin vitroアッセイ系を構築し、生理活性を有する物質の探索を行ってきた。上記の基盤研究により見いだされた抗ウイルス作用または抗がん幹細胞作用を有するヒット化合物について、協働機関と共同で周辺化合物の構造活性相関情報を得るとともに、 構造最適化へ向けた連携を強化させることで、実用化に向けた創薬開発研究をさらに加速させる。また、がんや難治性ウイルス疾患の分子病態を解明することで、新たな創薬ターゲットを見いだし、革新的な医薬品開発に発展させる。