ベーチェット病の分子遺伝学的発症機序について
~全ゲノム網羅的相関解析(GWAS)を終えて~
平成22年7月26日
横浜市立大学医学部眼科 水木信久
はじめに
ベーチェット病は全身の諸臓器に急性の炎症を繰り返す原因不明の難治性炎症疾患で、口腔内アフタ、眼症状、皮膚症状、陰部潰瘍を4主症状とします。近年の治療法の進歩により視力の予後は大きく改善してきましたが、今なお失明率の高い疾患です。本病は1937年に、トルコのベーチェット教授(Hulûsi Behçet;1889-1948)が、世界的に初めて報告したものです。しかしながら、ベーチェット病らしき病気は、紀元前5世紀には、古代ギリシャの医聖、ヒポクラテス(Hippocrates)により記載されており、また、紀元後200年には、中国の漢方医師、張仲景により、「傷寒雑病論」に"狐惑病"として記載されています。したがって、本病の歴史は大変古く、それが20世紀に入って初めてBehçetにより体系的にまとめられ、彼の名前に因んで「ベーチェット病」と名付けられたものです。本病は、人種を越えて、ヒトの主要組織適合抗原であるHLA(human leukocyte antigen)の特定のタイプ、HLA-B51抗原と顕著に相関しており、特定の内的遺伝素因のもとに何らかの外的環境要因が働いて発症する多因子疾患と考えられています。
ベーチェット病の疫学
本病は厚生労働省の特定疾患に指定されております。旧厚生省および厚生労働省の全国疫学調査によりますと、患者数は1972年には8,500人、1984年には12,700人、1991年には18,300人と年々増加していましが、2002年には15,000人と減少しました。性比(男/女)の推移をみますと、当初は男性患者が多かったものの、女性患者の増加により、現在は性差はほとんどありません。平均発症年齢は32.2歳(1972年)、35.5歳(1984年)、37.8歳(1991年)とこの20年間で上昇しています。また、ベーチェット病の症状にも変化がみられ、男女ともに完全型が減少しています。さらに過去1年間における臨床経過では、1991年は1972年に比べて、各症状の改善の頻度が大幅に上昇(24.5%→57.0%)し、逆に不変または悪化の頻度が大幅に減少(不変:42.0%→31.7%、悪化:30.1%→9.1%)しております。したがって、近年、ベーチェット病は軽症化傾向にあるといえます。これらのことより、受診しない軽症者の割合が増加したことが推測され、この軽症化が1991年から2002年にかけての患者数の減少に影響を与えた可能性も考えられます。そのため本病の患者数は潜在患者を考慮しますと報告数よりもかなり多いと推定されます。
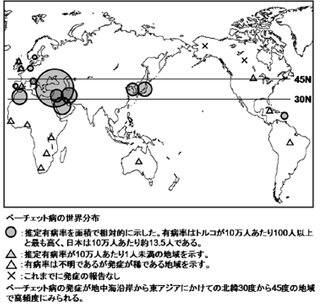
べーチェット病の世界分布
ベーチェット病は、世界的には地中海沿岸諸国(トルコ、ギリシャ、イタリア、フランス、チュニジア、モロッコ、エジプトなど)、中近東(サウジアラビア、イラン、イスラエル、レバノンなど)、東アジア(中国、モンゴル、韓国、台湾、日本など)といった北緯30度から北緯45度付近のシルクロード沿いに多発する疾患で、日本は最多発国の1つです。したがって、その背景には何らかの共通な外的環境因子の存在が疑われます。これらの地域の有病率は人口10万人当たり20-370人と多いのに対し、欧米では10万人当たり1人に満たない稀な疾患です(図1)。
一方、カリフォルニアやハワイには約80万人の日系アメリカ人が居住していますが、本病患者は全くいません。また、日系ブラジル人もサンパウロを中心に百万人以上居住していますが、本病患者はほとんど認められていません。日本人におけるベーチェット病の罹患率は約150人/100万人ですので、遺伝的にはこれらの日系アメリカ人や日系ブラジル人にも本病発症者が百人以上いてもおかしくありません。しかしながら、このように同じ内的遺伝素因を持った日本人でも、外的環境因子が異なる(カリフォルニア、ハワイ、ブラジルへ移住)と本病の発症率が大幅に低下することが知られています。このことは本病の発症は遺伝のみでは規定されていないことを示し、やはりシルクロード沿いの地域に共通した何らかの外的環境因子の存在を示唆しています。このようなことから、ベーチェット病は一種の風土病ではないかとも考えられており、"シルクロード病"とも呼ばれています。
ベーチェット病の病因
1.内的遺伝素因
(1)HLA-B51抗原
HLAとはヒトの主要組織適合抗原(MHC: major histocompatibility complex)のことで、赤血球、精子を除くほぼ全ての細胞の細胞膜に発現している膜結合型蛋白質です。元々はマウスの移植実験において、ドナーとレシピエント間で型を一致させると移植成績を著名に改善させる一連の抗原系として発見されたものです。HLAは類い稀なる高度な遺伝的多型性(個人差)を示し、自己の標識として、自己(自分:自己抗原)と非自己(他人、他の生物:外来抗原)の識別という免疫学的に大変重要な役割を担っています。したがって、HLAの多型(個人差)が外来抗原ペプチドに対する免疫応答の個人差を決定する遺伝要因となり、各疾患に対する感受性(かかりやすさ)を規定していることが示唆されています。
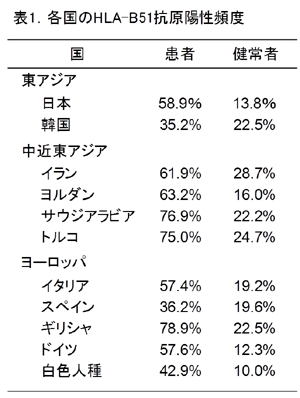
ベーチェット病では、人種を超えてHLA-B抗原の1つの型(タイプ)であるHLA-B51抗原が顕著に増加しています。患者群では、これらのどの民族においてもHLA-B51抗原頻度が40-80%であり、健常群の10-30%と比べて顕著に上昇しています(表1)。 HLA-B抗原は、現在までに遺伝的に600種類以上ものタイプが報告されていますが、本病患者ではその中の特定のタイプ、すなわちHLA-B51抗原が顕著に増加しています。興味深いことに、HLA-B51抗原とアミノ酸配列が2箇所しか異なっていないHLA-B52抗原は、本病患者群では全く増加していません。したがって、このHLA-B51分子特異的な2箇所のアミノ酸(63番目のアスパラギンと67番目のフェニルアラニン)が本病発症に重要な役割を担っているという仮説が提唱されています。
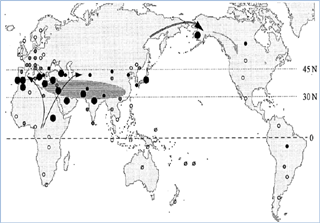
前述しましたように、ベーチェット病は、世界的には地中海沿岸諸国、中近東、東アジアといった北緯30度から北緯45度付近のシルクロード沿いに多発する疾患です。これらの国々は、HLA-B51抗原頻度の高い国々として知られており、ベーチェット病の好発国はHLA-B51抗原の世界分布と一致しています(図1、図2)。
(2)HLA-A26抗原
近年、第6染色体のHLA領域を詳細に解析したところ、HLA-B遺伝子領域からテロメア側(染色体末端側)に約1000kb離れたHLA-A遺伝子領域がHLA-B遺伝子領域とは独立して、ベーチェット病と相関していることがわかってきました。そして、HLA-A抗原の1つの型であるHLA-A26抗原が、HLA-B51抗原とは連鎖しないで独立に本病と相関していることもわかってきました。したがって、HLA-A26抗原をコードするHLA-A26対立遺伝子は、ベーチェット病の第2の疾患感受性遺伝子であることが示唆されています。この両抗原のどちらかを保有している患者はベーチェット病患者全体の80%弱にまで上ります。HLA-B51抗原とHLA-A26抗原のどちらを保有するか、または両抗原とも保有するか、両抗原とも保有しないか、ということで、ベーチェット病の病態や重症度に違いも表れています。
2.外的環境要因
ベーチェット病はシルクロード周辺諸国に多発する疾患であり、患者群では、これらのどの民族においてもHLA-B51抗原頻度が50-70%であり、健常群の10-30%と比べて顕著に上昇しています。しかしながら、健常群の10-30%のHLA-B51抗原陽性者といいますと、各民族で数百万~数千万人単位のHLA-B51抗原陽性者が存在していることであり、それにも関わらず、本病患者は高々数万人程度しか存在しません。すなわち、HLA-B51抗原陽性者のほんの一部の人のみが、ベーチェット病を発症していることになります。このことは、本病発症に何らかの外的環境因子の関与や、HLA-B51やHLA-A26以外の他の内的遺伝因子の関与を示唆しています。前述しましたように、カリフォルニアやハワイやブラジルに居住の日系二世、日系三世に本病患者がほとんど見られないことを考え合わせますと、本病発症には何らかの外的環境因子が関与している可能性は高いといえます。
ベーチェット病の命名者であるBehçet教授は、本病の外的環境因子として、ウイルスをあげています。その後、単純ヘルペスウイルスの関与が提唱された時期もありました(ウイルス説)。また、我が国のベーチェット病は、第二次大戦後、ことに昭和35年頃より急増しており、農薬使用量の増加や環境汚染と時期が一致していたことから、微量化学物質による環境汚染説も提唱されました。その他、免疫異常説、細菌感染・アレルギー説などが提唱されました。近年、歯科治療(抜糸)後や扁桃炎後、本病が悪化したとの報告があり、これには口腔内に常在する連鎖球菌の一種であるStreptococcus sanguisが直接関与しているという仮説が提唱されました。この仮説では、免疫原性があり、系統発生学的に種を越えてよく保存されているHSP(heat shock protein: 熱ショックタンパク質)が注目され、細菌由来のHSP65とヒトミトコンドリア由来のHSP60 に類似したペプチドが存在しているため、リンパ球(T細胞)が誤って交叉反応を起こしてしまうという分子擬態説(molecular mimicry説)が提唱されました。しかしながら、これらのどの仮説も、未だ確固たるエビデンスが得られておらず、本病の外的要因に関してはほとんど解っておりません。
ベーチェット病の全ゲノム網羅的相関解析(GWAS:genome-wide association study)
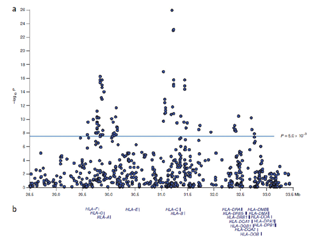
図3 HLA領域のGWASデータ
(Mizuki et al: Nature Genetics 42(8), 2010)
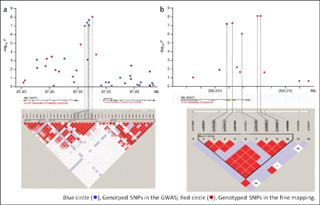
図4 IL23R-IL12RB2とIL10の2遺伝領域の
詳細なSNP解析(fine mapping)と連鎖不平衡
(Mizuki et al: Nature Genetics 42(8); 2010)
このようにベーチェット病は、細菌やウイルスなど何らかの外的な病因抗原に対し、HLA-B51やHLA-A26といった特定のHLA抗原を保有することにより過剰な免疫応答が惹起されて発症する疾患と考えられます。しかし、先ほど述べましたように、HLA以外にも疾患に関わる遺伝子が存在している可能性が高いと考えられます。
ヒトのゲノム上には個人による塩基配列の違い、これを1塩基多型、SNP(single nucleotide polymorphism)と呼びますが、これが数え切れず存在しています。この塩基配列の違いにより、さまざまな個人の特性が規定されます。病気に対する感受性、すなわち、かかりやすさの個人差もSNPによって異なります。そこで、私達はAffymetrix社のGene Chip Human Mapping 500k Array set というDNAチップ(マイクロアレイというガラスの基盤上に50万個のSNPがプロットしあり、全ゲノム上の50万か所の遺伝的多型性を一気に解析できる試薬と装置)を用いて、ベーチェット病患者を対象として全ゲノムの網羅的相関解析、すなわち、GWASを行いました。
日本人患者612人および日本人健常者740人を対象にしてGWASを行い、トップランクの有意性を示すSNPを検出しました。まず始めに50万個のSNPについて、SNP call(タイピングできた検体の比率)、ハーディワインバーグ平衡、マイナーアリル頻度の検定を行い、統計解析に適さないSNPを除外し、およそ32万個のSNPについて相関解析を行いました。患者群で1人、健常群で3人がDNA qualityの問題で解析不能でしたので、611人と737人で解析を行いました。まず、HLA領域のSNPの相関解析の結果を図3に示します。縦軸が統計学的有意差検定を表すP値で、横軸がゲノムの位置を示しています。HLA-B遺伝子領域に非常に強固な相関があり、本病の第1の疾患感受性遺伝子と考えられます。また、HLA-A遺伝子領域にも2番目に強固な相関があり、本病の第2の疾患感受性遺伝子と考えられます。これらは、以前の私達の結果を支持しています。
次に、HLA領域以外では、P値がマイナス5乗のオーダーで相関するSNPが54個認められました。その後、トルコ人でGWASを行っている海外のグループと、データの相互評価、相互検討をしましたところ、IL23R-IL12RB2遺伝子領域、すなわち、インターロイキン23レセプターとインターロイキン12レセプターが近接して存在している領域と、IL10、すなわちインターロイキン10そのものをコードする遺伝子領域に本病と強く相関した遺伝変異が認められました。これらの遺伝子は異なる日本人患者集団においても同様の相関を示し(replication study)、全体でP値が10-8と非常に強く本病と相関していました。そこで、これら2か所の遺伝領域について、DNAチップ内のラフなSNP解析ではなく、その間を密に埋めるようにSNPを抽出して詳細なSNP解析(fine mapping)を行いました。図4にこれら2遺伝領域のfine mappingの結果を示します。左側がIL23R-IL12RB2遺伝子領域です。両遺伝子の近接している丁度真ん中の領域のSNPが最も強く本病と相関していました。したがって、この遺伝変異により、IL-12とIL-23のどちらかのレセプター、もしくは、両方のレセプターが機能異常をきたしており、本病のかかりやすさに有意に影響をあたえていることが示唆されました。右側がIL10遺伝子領域です。IL10遺伝子の5'非翻訳領域、すなわちプロモーターが存在する領域にベーチェット病に相関した遺伝変異が存在していました。しかし、これらの遺伝子が真にベーチェット病の疾患感受性遺伝子であるためには、これらが民族特異的な相関ではなく、多民族でも同様に相関していることが必要です。そこで、先ほど示したfine mappingのSNPの中から、日本人で最も強く相関していたtag SNPに関して、人種を変えて再現性をみてみました(表2)。トルコ人患者集団1,215人とトルコ人非患者集団1,279人、および韓国人患者集団119人と韓国人非患者集団140人を対象にメタ解析と追認試験(population based study)を行ったところ、日本人同様の強い相関が認められ、このIL10とIL23R-IL12RB2遺伝子領域は人種を超えてベーチェット病の発症に深く関わっていることが示唆されました。したがって、これら遺伝子領域のわずかな違い(SNP)により、ベーチェット病の発症リスクが有意に高まることが明らかになりました。 その後の発現解析では、このベーチェット病のリスクSNPと相関して、IL-10のmRNAの発現が低下していることもわかりました。
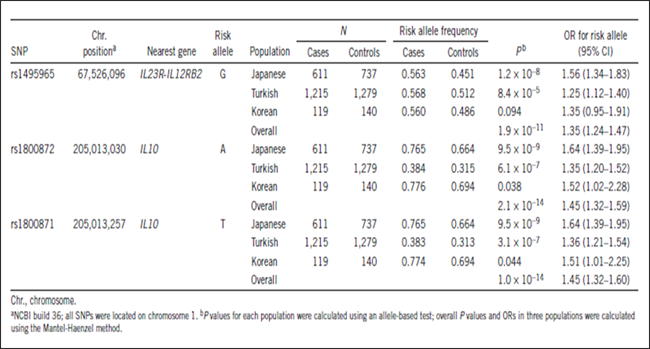
表2 IL23R-IL12RB2とIL10遺伝領域のtag SNPの各民族における相関
(Mizuki et al: Nature Genetics 42(8); 2010)
ベーチェット病の分子遺伝学的発症機序の仮説
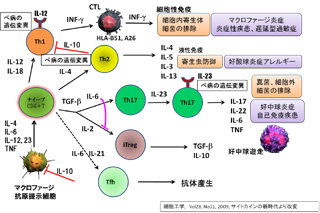
ベーチェット病は以前からHLA-B51分子との関係が示唆されており、本病の第一の疾患感受性遺伝子であることは疑いありません。また、近年、HLA-A26分子も本病の発症に強く関わっていることがわかってきました。したがって、本病発症の最初の免疫応答は何らかの病原となる抗原(病因抗原)をHLA分子が認識して発動されると考えられます。HLAクラスII分子との相関はあまり強くはないため、病因抗原の一部がHLAクラスII分子に結合されてナイーブなヘルパーT細胞へ抗原提示される過程では、どのタイプのHLAクラスII分子であっても大きな偏り(各HLAクラスII分子による個人差)はなくナイーブヘルパーT細胞に抗原提示がなされると考えられます。そして、その病因抗原を提示されたナイーブヘルパーT細胞は、IL-12などのサイトカインを産生し、Th1タイプのヘルパーT細胞へと分化・誘導されていきます。このように、ベーチェット病ではTh1優位の免疫応答が惹起されており、IFN-γ(インターフェロン-γ)を介して、細胞傷害性T細胞(cytotoxic T cell: CTL;[キラーT細胞])やNK(natural killer)細胞を活性化させます(細胞性免疫)。細胞傷害性T細胞の表面には、HLAクラスI分子が発現しておりますので、HLA-B51分子やHLA-A26分子を保有している人では、この段階で過剰な免疫応答が惹起されていくと考えられます。今回のGWASの解析では、Th1細胞に発現しているIL-12レセプターや、Th17細胞に発現しているIL-23レセプター、それと、Th1系の免疫応答に抑制的に働くIL-10分子にベーチェット病に関係した遺伝変異が発見されました。そこで、次に、これらの遺伝変異と本病発症の関係について考察してみます。
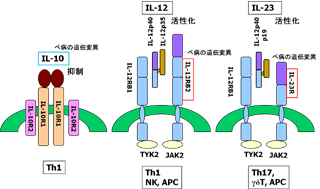
図5にべーチェット病との関係が示唆されたIL分子とその受容体の模式図を示します。細胞性免疫に関わるTh1細胞やNK細胞、抗原提示細胞(APC: antigen presenting cell)などに発現しているIL-12のレセプターであるIL12RB2にベーチェット病と相関した遺伝変異がありました。また、炎症性疾患発症に深く関与した、Th17細胞(ヘルパーT細胞タイプ17)やγδT細胞、マクロファージなどの抗原提示細胞に発現しているIL-23のレセプターのIL23Rにもベーチェット病の発症に関わる遺伝変異が認められました。また、IL-10分子そのものにも、そのプロモーター領域にベーチェット病と相関した遺伝変異が認められ、IL-10の発現量を左右させることが示唆されました。
図6に獲得免疫系のサイトカインとベーチェット病の関係を示します。Th1細胞は主にIFN-γを産生することにより、細胞傷害性T細胞を活性化して細胞性免疫に関与します。ベーチェット病では、以前より、HLA-B51やHLA-A26分子との顕著な相関が示唆されており、Th1優位の免疫異常が起きていると考えられていました。Th1細胞はIL-12により分化・誘導され、その働きはIL-10により抑制されています。今回、IL-10の発現量を低下させるような遺伝変異がベーチェット病で示唆されました。また、IL-12のレセプター領域にも本病と相関した遺伝変異が示唆され、IL-12に対する反応性が異なっている可能性(IL-12に対する易刺激性の亢進)が考えられます。 したがって、今回見つかった本病の遺伝変異は、Th1系の免疫応答を抑制するサイトカインであるIL-10の発現を低下させ、また一方で、Th1細胞の易刺激性を亢進するような変異であるのではないか(どちらも結果的にTh1系免疫応答を活性化する)と考えております。
また、今回、IL-23のレセプター遺伝子領域にも本病に関わる遺伝変異が見つかりました。IL-23レセプターはTh17細胞やマクロファージに発現しており、IL-23はTh17細胞の増殖と維持、活性化に関与します。近年、Th17細胞は細胞外細菌排除などの感染防御、好中球炎症や自己免疫疾患発症に深く関わっていることが示唆されております。ベーチェット病では、以前より、特殊な連鎖球菌に対する免疫応答(感染防御)が亢進しており、これらの細菌感染が疾患発症のトリガーになっている可能性が示唆されていました。そして、それにより好中球が病巣に異常に遊走され、好中球自体の機能も亢進して暴走していることが本病病態を形成していると考えられていました。したがって、今回の解析で得られた、IL-23レセプターの遺伝変異により、このTh17細胞のIL-23に対する易刺激性が亢進して、本病発症に促進的に働いている可能性が考えられます。
以上まとめますと、ベーチェット病では、その病因となる外来抗原がHLA分子を介して、最初の免疫応答を惹起させ、その後、Th1系免疫応答、Th17系免疫応答が発動されていく過程で、それらの細胞表面のレセプター分子(IL-12レセプターやIL-23レセプター分子)の異常や、それらを制御するサイトカイン(IL-10分子)の異常などにより、これらの免疫系が加速・進展していき、歯止め(ブレーキ)もかけられない状態に陥っているのではないかと考えております。このように、今回の研究(GWAS)でベーチェット病発症に関わる遺伝変異が非HLA遺伝子であるIIL23R-IL12RB2とIL10の2遺伝領域に見つかったことは、本病の病態の解明およびそれらのサイトカインを制御する生物製剤の開発の上で大変意義深いと考えております。
ベーチェット病治療における生物製剤の可能性
前述しましたように、ベーチェット病の基本病態は好中球の機能過剰(暴走)であり、TNF(tumor necrosis factor:腫瘍壊死因子)やIL-1, IL-6などの炎症性サイトカインが本病発症に大きく関与しています。また、今回、IL-23Rの遺伝変異に伴うTh17細胞の活性化(IL-17、IL-22、IL-6、TNFの産生増加)やTh1を抑制するIL-10の遺伝変異に伴うIL-10の発現低下が本病発症に関与している可能性が示唆されました。したがって、それらの細胞やサイトカインを制御するような生物製剤が本病の有効な治療薬となり得る可能性があります。
現在、ベーチェット病の治療薬に使われる生物製剤としては、インフリキシマブ(infliximab、商品名レミケード)があります。これはTNFαに対するキメラ型モノクローナル抗体で、2007年1月に世界に先駆けて本邦で初めて、ベーチェット病の難治性網膜ぶどう膜炎に対して投与が承認されました。TNFαはサイトカインネットワークの中でも比較的上流部に位置しており、各種炎症性サイトカインを上流で制御している中心的なメディエーターです。したがって、その阻害剤であるインフリキシマブは本病に対して大変優れた治療効果があり、他の治療薬で効果不十分の難治性ベーチェット病患者の約9割に有効です。活動性の強い難治性ベーチェット病では、以前はどのような薬を用いても中々消炎することが困難でしたが、そのような患者さんの9割に著効を示すということは画期的なことです。しかし、残念ながら、本剤に効きが悪い(不応答性)患者さんも1割程度存在しており、このような患者さんはどのような治療薬も効果がなく、ミゼラブルな状況に陥ってしまうこともあります。そういった意味からも、また治療の選択肢を広げる意味からも、インフリキシマブ以外の生物製剤の開発が必要であります。
同様のTNFαに対する生物製剤としては、関節リウマチなどで承認されていますTNF受容体(p75)/Fc融合蛋白であるエタネルセプト(Etanercept、 商品名エンブレル)、TNFαに対する完全ヒト型モノクローナル抗体であるアダリムマブ(Adalimumab、商品名ヒュミラ)などがあります。どれもTNFαの作用を抑制するため、ベーチェット病への治療効果が期待されますが、ベーチェット病の治療薬としては未だ承認されていません。アダリムマブは現在、ベーチェット病を含む難治性ぶどう膜炎の治療薬として臨床試験が始まっています。
一方、IL-6に対する生物製剤としては、これもベーチェット病では承認されていませんが、関節リウマチなどの治療に使われるIL-6レセプターに対するヒト化型モノクローナル抗体であるトシリズマブ(Tocilizumab、商品名アクテムラ)があります。ナイーブなヘルパーT細胞は、一般にTGF-βの刺激により、IL-6の存在下ではTh17細胞へ分化・誘導され、Treg(IL-10を産生して免疫応答を抑制的に調整するT細胞)への分化は抑制されますが、IL-6が存在しないとTh17には分化されずにTregに分化・誘導されることが知られています。したがって、トシリズマブはIL-6の働きを阻害することにより、今回私たちがGWASの結果より想定した本病の発症プロセスや病態形成を効率的に抑え、本病の有効な治療薬となる可能性が考えられます。すなわち、ナイーブなヘルパーT細胞からTh17細胞への分化・増殖を抑え、Tregへと分化・誘導させることにより、Th17による免疫応答の減弱や、Tregによる免疫反応抑制的なIL-10の産生増加を来すことが期待されます。しかし、トシリズマブは感染症の重要な血液検査マーカーであるCRPをマスクしてしまう(CRPが検出できなくなる)ため、感染症のモニタリングが困難となり、その使用には十分注意しなくてはなりません。
また、現在、難治性ぶどう膜炎患者を対象として、IL-17モノクローナル抗体(AIN457) の臨床試験も始まっておりますが、残念ながら、この試験からベーチェット病は除外されております。しかし、私達のGWASの結果からは、この抗体製剤はベーチェット病にも十分効くことが予想され、今後、ベーチェット病への適応獲得のため臨床試験の実施を働きかけていきたいと考えております。また、今回の結果を踏まえますと、IL-12、IL-23、IL-22分子、特にIL-23分子そのものや、それらのレセプターに対する抗体製剤も本病の有効な治療薬となり得る可能性があります。今後、これらの生物製剤の開発や臨床試験の実施が期待されます。
おわりに
ベーチェット病は、原因不明の全身性の難治性炎症性疾患です。近年、本病の軽症化や新しい治療薬の開発により、本病の視力予後は改善されてきました。しかし、以前として本病により重篤な視力障害、後遺障害を起こす患者さんは存在しています。本病は東アジア~中近東、地中海沿岸のモンゴロイド(東洋人)に多発し、欧米人には稀な疾患です。本病の病態の解明および有効な治療法、予防法の開発は、私たち日本人の双肩にかかっており、私達の責務といえます。