膵腫瘍の治療
1.はじめに
難治がん、希少がんといえども「唯一の根治療法」は手術による切除です。しかし、難治がん、希少がんの多くは、進行が速いあるいは、無症状であり発見が遅れるなどの理由で、見つかった時点で手術ができないほど大きくなっているか転移していることが多く、手術ができるのはむしろ少数であるといえます。難治がん、希少がんの多くは、小さな段階では特徴的な症状がなく、また一般的な健康診断では見つけにくいため、手術ができないくらいに大きくなるまで自覚症状がでないのです。
横浜市大臨床腫瘍科では、難治がんの代表である手術不能な膵臓がんと希少がんのうち代表的な手術不能な神経内分泌腫瘍に対して重点的に治療を行っています。以下に、一般的な治療方法と、当科における取り組みをご紹介します。
2.切除不能膵臓がんに対して
膵臓がんの患者5年生存率は10%以下であり最も予後の悪いがんの一つです。一方で、膵臓がんは徐々に増加しており、2019年の統計によれば、命に係わるがんとしては4番目に多いと報告されています。また膵臓がんは、診断に有効な検診手段が未だ確立していないため早期発見が非常に難しく、診断がついた時には、周りの臓器に広がっていたり、肝臓やリンパ節などの全身臓器へ転移している転移性膵臓がんとして発見されます。
膵臓がんは、病気の広がりによるステージ分類では、ステージ1,2の方は少なく、進行したステージ3,4の状態で病気が見つけられることが大半です。ステージ3は、局所進行膵臓がんのことで、主に周囲の動脈や静脈との関係から、切除可能、切除可能境界、切除不能と分けられます。これらのがんでは、切除を中心に、抗がん剤、時には放射線を含めた治療(集学的治療)が行われます。手術の前の抗がん剤治療を術前補助化学療法、放射線を併用する場合は、術前補助化学放射線療法、手術の後の抗がん剤治療を術後補助化学療法と言います。一方でステージ4は、遠隔転移を伴う膵臓がんのことで、切除ができないため、延命目的のため、抗がん剤治療が行われます。以上のことを言い換えると、膵臓がんと診断された方々のほとんどは、まずは何らかの抗がん剤による治療を受けることが勧められるわけです(図1)。20年ほど前は、膵臓がんに対しては、手術以外の治療はほとんどありませんでしたので、抗がん剤の役割が増しており、以前であれば手術が出来なかった方でも手術ができる可能性が広がり、手術ができない方も長生きができるようになって来ていると言えるでしょう。また最近になり、膵臓がんの領域においても、遺伝子異常に基づいた治療が認められるようになり、更なる発展が期待されています。膵臓がんに施行される抗がん剤をご紹介します。
膵がん 抗がん剤 年表

1) ゲムシタビン(GEM)+ナブパクリタキセル(nab-Paclitaxel)
1997年に出された論文で、膵臓がんに対する有用性が確認されて以来、ゲムシタビンは膵臓がんに対する世界的な標準治療薬と位置づけられていました。ゲムシタビンは、膵臓がん患者様の生命予後を延長させるとともに、症状を緩和する効果(クリニカル ベネフィット)が得られることより、今日でも世界中で最も使用されている膵臓がんの抗がん剤と言えるでしょう。しかしながらその効果は限定的であり、腫瘍が縮小する方は5%であり生存期間中央値は5.7か月と報告されています。そのため、ゲムシタビンに何らかの治療薬を追加し、ゲムシタビンの効果をより強く、長くしようとする試みが長年続けられてきました。
2005年にエルロチニブがゲムシタビンと併用することで、予後改善効果が報告されました。しかし、エルロチニブと併用することで間質性肺炎の副作用が増加すること、肺がんと異なり効果的な患者さんの特徴がはっきりしないこと、また併用する方の予後の延長期間は、ゲムシタビン単独と比較して約10日間であったことなどより、実際にはエルロチニブが追加投与されることは現在ではあまりありません。
2013年になりゲムシタビンに、nab-Paclitaxelを併用することで、ゲムシタビン単独よりも生命予後が延長すると報告されました。ゲムシタビンが世の中に登場してから、16年かかったわけです。nab-PaclitaxelはもともとあったPaclitaxelを改良したものです。Paclitaxel は、アルコールとヒマシ油に溶解した抗がん剤であり、アルコールに弱い方やアレルギー反応が比較的出やすい抗がん剤でした。nab-Paclitaxelは、アルブミン(血液製剤)に溶かすことでこれらのリスクが回避されました。また、併用することで腫瘍内におけるゲムシタビンの濃度が上昇するとも説明されており、ゲムシタビンと相性の良い組み合わせといえます。現在ではゲムシタビンとnab-Paclitaxelの併用療法は、切除不能膵がんの標準治療となりました。
2) TS-1(S-1)

フッ化ピリミジンという薬剤の飲み薬で、胃癌、大腸癌、乳癌など様々ながんに使用されています。
日本で行われた臨床試験により膵臓がんに対するTS-1はゲムシタビンと同様の効果が認められることが証明され、標準治療のひとつとして考えられています(2011年米国臨床腫瘍学会:ASCOで発表)。
またゲムシタビンとS-1を併用して治療するGS療法も同様な治療効果が認められており選択肢の一つとなります。また最近の報告で、切除可能膵がんに対して、術前補助化学療法としてGS療法を行ってから手術を行うと、何もせず手術を行った患者さんより生存予後が延長するという研究が日本から発表され、GS療法は改めて注目されている治療方法です。またS-1は、術後の補助化学療法として、6か月間内服することで、ゲムシタビンを6ヶ月行うよりも、生命予後が延長すると報告されており、現在では、膵臓がんの手術を受けた患者さんのほとんどが、術後にS-1の半年の内服が勧められていると思います。
3) FOLFIRINOX
2011年フランスのグループからFOLFIRINOX療法の有効性、安全性に関する論文が報告されました。FOLFIRINOXとはフッ化ピリミジン(5FU)、イリノテカン(商品名 トポテシン)、オキサリプラチン(商品名 エルプラット)という3つの抗がん剤を併用投与する治療法です。FOLFIRINOX療法はそれまでの標準治療であるゲムシタビンの単独投与に比べて2倍に迫る生存期間の延長が確認され、新たな標準治療となりました。3剤併用という厳しい治療ではありますが、副作用は対応可能な範囲であり、全身状態が良好な切除不能膵臓がんには標準治療といえるでしょう。FOLFIRNOXは、副作用が比較的多くみられることより一次治療(最初に行う抗がん剤)として行われることが多いですが、時に、二次治療として実施されることもあります。患者さんの体調による影響が大きいですが、減量することや治療のスケジュールを考慮すれば利益が得られる方もいらっしゃることを、われわれは報告してきました1)。一方で、一次治療としてもあまり適切ではない方もいらっしゃることもあり、明確な指標がないことが問題でした。そこでわれわれは、当院のデータをもとに、FOLFIRINOXを受けた患者様の筋肉の量や脂肪量を調べると、生命予後や副作用と関連があることが分かり報告してきました2)。
4) Nal-IRI (オニバイド)+5FU/LV
イリノテカンは、FOLFIRINOXの際にも使用される抗がん剤ですが、ナノリポゾーマル化することで、腫瘍内でのみ濃度が上昇するようにした薬剤が、オニバイドです。5FUとLVを併用しますので、FOLFIRINOXから、オキサリプラチンを抜いたものとよく似ている治療といえます。FOLFIRINOX同様、CVポートが必要です。この治療の注意点は、ゲムシタビンを含む抗がん剤治療を受けた後の患者様に適応であるということです。ゲムシタビンとアブラキサンの併用の後でももちろんかまいません。国際的な第三相試験をもとに、保険適用となった治療であり、二次治療としてのエビデンス(証拠)は確かであるといえるでしょう。
5) ペンブロリズマブ と オラパリブ
ペンブロリズマブは、免疫チェックポイント阻害薬と言われるもので、2018年 京都大学の本庶先生が、ノーベル賞を取った、PD1という分子に対する抗体薬です。本来は、自分の体の細胞の一部であったがん細胞は、最終的には自分の体をむしばむ異物として振舞います。ですから本来は、自らの免疫の力で異物であるがん細胞は排除されるはずです。これは、細菌やウイルスで侵された細胞が、免疫の力で除去されるのと同様に考えられます。しかしながらがん細胞は、様々なメカニズムで、本来の患者さん自身が持っている免疫の働きを回避して、増殖しています。その免疫回避のメカニズムの一つがPD-1という分子です。がん細胞にPD1に対するリガンド(結合部位)が発現することで、リンパ球にPD1が発現し、リンパ球が本来持っている、異物を除去する働きが弱っているのです。そこにPD1抗体を投与することで、本来のリンパ球の働きが復活し、腫瘍細胞に攻撃を開始するわけです。これが、免疫チェックポイント阻害薬の働きです。これまでの様々な研究で、がんの種類にかかわらず、MSI(マイクロサテライト不安定性)が高いという遺伝子異常のタイプのがんでは、このPD1抗体がよく効くことが分かっており、膵臓がんでも、MSIが高いタイプの異常を持った患者さんは、PD1抗体である、ペンブロリズマブが使用できます。しかしながらこのタイプの異常は、膵臓がんでは、極めて少ないといわれています。
また、最近になり、オラパリブという薬も膵臓がんに認められた新薬です。
オラパリブは、パープ阻害薬と言われるお薬で、卵巣がんや乳がんを引き起こしやすい、BRCA1/2というタイプの遺伝子異常を持った、膵臓がんの方に使用されます。ただし、オキサリプラチンなどのプラチナ系を含む抗がん剤治療を受けて、一定の治療効果があった患者さんの病気の進行を抑える(維持する)目的で使用されるお薬であり、すべての膵臓がんのかたに使用できるわけではありません。またBRCA1/2を持った膵臓がんの患者さんでも全員に効果があるとは言えません。またこの遺伝子異常も比較的まれなものであり、残念ながら9割以上の膵臓がんのかたには、この異常は認められないといわれています。
3.切除不能膵神経内分泌腫瘍に対して
神経内分泌腫瘍はあまり聞きなれない腫瘍だと思いますが、最近では診断能力の向上に伴って、国内外で増加傾向にあります。神経内分泌腫瘍は、おもに膵臓と消化管に発生することが多く、以前は、病気の進行が遅いことからカルチノイド(がんのようなもの)といわれたり、内分泌(ホルモン)を産生することから、インスリノーマ(インスリンを出し、低血糖を起こす)、ガストリノーマ(ガストリンを出し、胃潰瘍や十二指腸潰瘍を起こす)などとも呼ばれていたものの総称です。進行の遅い悪性度の低いものをNET(神経内分泌腫瘍)、進行が比較的早く悪性度の高いものをNEC(神経内分泌がん)と呼び、全てをまとめてNENと総称するようになりました。NENはまだまだ珍しい病気であるため、これまでは医療者や製薬会社からも注目されにくく、特に国内では、診断から治療までその診療体制が残念ながら欧米に比べ遅れを取っておりました。われわれは以前よりこの疾患に注目し、重点的に対応を行うことで国内の神経内分泌腫瘍の診療体制の構築に貢献してきました。
1) 神経内分泌腫瘍(NEN)について
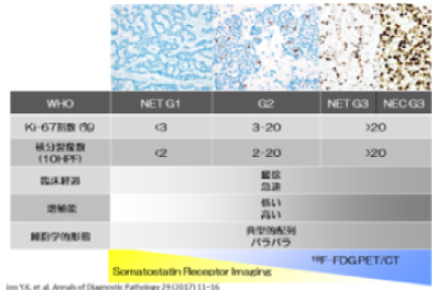
NEN(神経内分泌腫瘍)は4つのグループに大別されます。これは2019年に世界保健機構WHOが提唱した膵・消化管神経内分泌腫瘍の分類法に従ったものです。NETグレード1とNETグレード2は分化度が比較的高く悪性度が比較的低い予後の良いグループであり、中でも細胞分裂があまり起っていないものをNETグレード1、細胞分裂が少し目立つものをNETグレード2としています。グレード3は、以前は1つでしたが、高分化(悪性度の低いもの)と低分化(悪性度の高いもの)とが混在し混乱を招くため、NETグレード3(高分化で悪性度の低いもの)とNECに細分類されました。NECは神経内分泌がんと称されるもので分化度が低く、たちの悪いもので、細胞分裂も非常に多く目立つものです。
まずグレード1、グレード2に対する治療法を記します。
これまで症例数が少ないこともあり、できる限り外科的に切除する以外には、明確な治療方針がない疾患群でした。しかし2011年4 月オクトレオチド(商品名 サンドスタチンLAR)、2011年12月 エベロリムス(商品名 アフィニトール)、2012年8月スニチニブ(商品名 スーテント)が治療薬として相次いで保険適応となりました。また、2014年9月ストレプトゾシン(商品名 ザノサー)、2017年7月ランレオチド(商品名 ソマチュリン)が相次いで使用できることになりました。これらが保険適応になったことは極めて意義深いことで、神経内分泌腫瘍の治療に明るい兆しが見えてきたことを意味します。オクトレオチドとランレオチドは、ソマトスタチンアナログと言われるもので、筋肉ないし深部皮下への注射を1か月に1回程度行います。エべロリムス、スニチニブは飲み薬でいわゆる分子標的治療薬です。しかしこれらは、特殊な副作用が出現することや抗腫瘍効果(腫瘍を小さくする効果)は必ずしも十分ではないなどの問題点があります。ストレプトゾシンは点滴の注射剤でいわゆる抗がん剤です。繰り返す投与が必要であり、抗がん剤ですので吐き気などが問題となることがあります。当施設でも、切除不能と判断された症例ではこれらの治療をお勧めしておりますが、それ以外の方法としてペプチド受容体放射性核種療法( peptide receptor radionuclide therapy; PRRT )が最近になり承認されました。
2) オクトレオスキャンについて
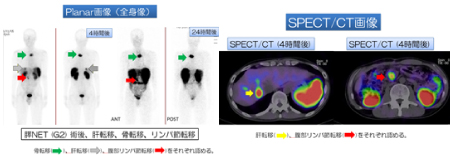
NET(神経内分泌腫瘍)の細胞の表面には、80~90%の割合でソマトスタチン受容体というレセプターが存在します。オクトレオスキャンとはソマトスタチン受容体に特異的に結合する物質(リガンド)をラジオアイソトープで標識した[111In]ペンテトレオチドという薬を静脈注射し、[111In]ペンテトレオチドが神経内分泌腫瘍のソマトスタチン受容体に結合するのを待ってから全身の写真を撮り、ラジオアイソトープの集まり具合を画像評価し、神経内分泌腫瘍のある場所を特定する方法です。オクトレオスキャンは欧米では医学の教科書に載っていますが、国内では長く保険上認められていない検査でした。そのため、2013年当時、われわれは、国立国際医療センター、放射線科 窪田和雄先生に、ご教授いただき、オクトレオスキャンが当院でも行えるようにいたしました。担当医師が実際に販売元のオランダに発注書類を直接送り、合わせて個人輸入の申請書類、通関書類を作成し、運送会社を通じて税関、関東厚生局に届を提出し薬監を取得することで日本にはない[111In]ペンテトレオチドを入手してきました(薬剤のキットはオランダから成田空港に到着し、運送会社による輸入手続きの後、病院へ配達されます)。到着後に放射線科で検定を行い十分に診断が可能な薬剤であることを確認した後に使用をいたします3)。われわれの試みが、どこまで影響を与えたかはわかりませんが、オクトレオスキャンは2016年にようやく日本での保険承認がなされました。
3) ペプチド受容体放射性核種療法
(peptide receptor radionuclide therapy; PRRT)について
ペプチド受容体放射性核種療法(peptide receptor radionuclide therapy;PRRT)は、放射線療法の一種で、先に述べた腫瘍細胞表面に発現しているソマトスタチン受容体を標的とします。ソマトスタチン受容体に結合するソマトスタチン類似物質と放射性同位元素であるルテシウム177をキレートで結合させたものを静脈内に、点滴で投与し、腫瘍細胞表面のソマトスタチン受容体を介して、腫瘍に取り込ませたのちに放射性同位元素から出るβ線が腫瘍細胞を破壊するという放射線内用療法です。奏効率(腫瘍の縮小する割合)は13~62%、無増悪生存期間(腫瘍が大きくならないでいる期間)は14~42か月、全生存期間は30~71ヶ月と報告されています。
本治療はヨーロッパを中心に1997年ごろから施行されていました。国内で使用することができない放射性核種であることより、この治療を目指して本邦からも多数の患者が訪欧していました。
当院からも、2011年からこれまでに41人の患者さんが、PRRTを古くから施行しているスイスのバーゼル大学に紹介、入院され、本治療を受けており、その結果を報告してきました4)。当教室では本学放射線科と共同でPRRTが日本国内でも施行できるよう2012年から検討を重ねてきました。法的規制や治療設備の問題等の障害があり、治療困難な状態が続いていましたが、2017年にようやく企業治験が開始され、2021年6月23日ソマトスタチン受容体陽性の神経内分泌腫瘍を適応症として国内承認されました。当院では、2017年6月の第1相治験、2018年4月の第1/2相治験に携わり報告を行ってきました。スイスに患者さんをお送りしてから、実に10年の歳月がかかりようやく国内での実施に至りました5)。
しかしながら、一般の個室を、この治療に対応できる特別な防護措置を行った部屋に変える必要から、多くの医療者による準備や対応が必要になることもあり、保険適用になっても、施行可能な施設はいまだ少なく、多くの施設で実施するにはまだ時間がかかると思われます。治療が必要な患者様が困らないよう、施行可能な施設と連携を取りながら国内ネットワークを構築することが現在の課題であり、その役割を果たすことがわれわれの使命です。
4) 切除不能膵神経内分泌がん(NEC)に対して
神経内分泌がんはneuroendocrine carcinoma(NEC)と呼ばれます。
NECは全生存期間が、6から16カ月と言われており、極めて予後の悪いがんです。NECの治療は、外科的切除術が唯一の根治術ですが、転移を伴う進行した状態で発見されることが多いことから、一般的には、抗がん剤治療が施行されます。欧米の治療ガイドラインによれば抗がん剤のシスプラチン(またはカルボプラチン)+エトポシドの併用療法が一般的です。国内では、切除不能あるいは転移性NECでは、シスプラチン+イリノテカン、シスプラチン(またはカルボプラチン)+エトポシドの併用療法が一般的であるとされています。しかしながら、これらの治療に抵抗性を持ったNECの治療は、様々な治療薬が検討されてきましたが、明確な次の治療方法(二次治療)は確立していません6)。NECは、病理学的に小細胞肺がんと似ていることが多く、治療方法もこれに準じて発展してきた経緯があります。小細胞肺がんは、限局型と進展型に分けられ、限局型では、シスプラチン+エトポシドの併用化学療法に、放射線治療を併用する方法が最も一般的です。NECでも上手に放射線治療を組み合わせていくことが大事なのかもしれません。また、一方の進展型では、シスプラチン+イリノテカン、シスプラチン(またはカルボプラチン)+エトポシドの併用が一般的に行われていました。しかしながら、最近になり、比較的全身状態が良好な進展型の小細胞肺がんの患者さんに,カルボプラチン+エトポシド+アテゾリズマブ(PD-L1阻害薬)後にアテゾリズマブ単剤での維持療法を行うとカルボプラチン+エトポシドだけの治療より生存期間が延長することが報告されました。また、シスプラチン(またはカルボプラチン)+エトポシド+デュルバルマブ(PD-L1阻害薬)後にデュルバルマブ単剤での維持療法を行うと、シスプラチン(またはカルボプラチン)+エトポシドによる化学療法のみを行うよりも、生存期間が延長することが報告されており、体調の良い進展型の小細胞肺がんの患者の患者さんには、プラチナ製剤/エトポシド併用療法+PD-L1阻害薬の併用治療を行うことが勧められています。また我々は、NEN症例の手術標本をもとに免疫担当細胞の発現を調べたところ、NECの症例では、NETの症例よりもPD1を発現しているリンパ球が多いことを報告しました7)。このことから、NETよりもNECでむしろ、PDL-1阻害薬が有用である可能性があること、また従来の抗がん剤治療にPD-L1阻害薬の併用治療を行うほうがより効果的である可能性があるのではないかと考えています。
| 1) | Effect of FOLFIRINOX as second-line chemotherapy for metastatic pancreatic cancer after gemcitabine-based chemotherapy failure. Kobayashi N, Shimamura T, Tokuhisa M, Goto A, Endo I, Ichikawa Y. Medicine (Baltimore). 2017;96(19):e6769. |
| 2) | Sarcopenia is a reliable prognostic factor in patients with advanced pancreatic cancer receiving FOLFIRINOX chemotherapy. Kurita Y, Kobayashi N, Tokuhisa M, Goto A, Kubota K, Endo I, Nakajima A, Ichikawa Y. Pancreatology. 2019;19(1):127-135. |
| 3) | Clinical Usefulness of Somatostatin Receptor Scintigraphy in Japanese Patients with Gastroenteropancreatic Neuroendocrine Tumors. Hasegawa S, Kobayashi N, Tokuhisa M, Goto A, Takano S, Takada Y, Kaneta T, Mori R, Matsuyama R, Endo I, Yamanaka S, Nakajima A, Inoue T, Ichikawa Y. Digestion. 2017;96(1):13-20. |
| 4) | Retrospective study of peptide receptor radionuclide therapy for Japanese patients with advanced neuroendocrine tumors. Kobayashi N, Wild D, Kaul F, Shimamura T, Takano S, Takeda Y, Okubo N, Suzuki A, Tokuhisa M, Ichikawa Y. J Hepatobiliary Pancreat Sci. 2021;28(9):727-739. |
| 5) | Safety and efficacy of peptide receptor radionuclide therapy with 177Lu-DOTA0-Tyr3-octreotate in combination with amino acid solution infusion in Japanese patients with somatostatin receptor-positive, progressive neuroendocrine tumors. Kobayashi N, Takano S, Ito K, Sugiura M, Ogawa M, Takeda Y, Okubo N, Suzuki A, Tokuhisa M, Kaneta T, Utsunomiya D, Hata M, Inoue T, Hosono M, Kinuya S, Ichikawa Y. Ann Nucl Med. 2021;35(12):1332-1341. |
| 6) | Phase II study of temozolomide monotherapy in patients with extrapulmonary neuroendocrine carcinoma. Kobayashi N, Takeda Y, Okubo N, Suzuki A, Tokuhisa M, Hiroshima Y, Ichikawa Y. Cancer Sci. 2021;112(5):1936-1942. |
| 7) | Pathological Findings of the Host Immune Reaction in the Tumor Microenvironment of Gastroenteropancreatic Neuroendocrine Neoplasms. Hasegawa S, Kobayashi N, Okubo N, Tokuhisa M, Goto A, Kurita Y, Sato T, Hosono K, Endo I, Nakajima A, Ichikawa Y. Intern Med. 2021;60(7):977-983. |
| 【連絡先】横浜市立大学附属病院(代表) 045-787-2800 |
|---|


