研究活動
体細胞不定胚の研究
体細胞不定胚
植物細胞には、一度特定の器官に分化した細胞から再び新しい個体が生じる能力(分化全能性)があります。この時、新しい個体が胚として生じる場合を体細胞不定胚形成と呼びます。不定胚は、受精胚と同様に発達して正常な植物体へと成長します。不定胚には、組織培養によって大量に増殖できる、発達段階を揃えることができる、胚組織が単独で存在し観察や単離が容易である、クローンであり個々の性質が安定している、など多くの研究上の利点があります。そのため、不定胚は受精胚形成の実験モデルとして広く利用されています。1958年に最初に不定胚形成が発見されたニンジンは、不定胚に関する研究が最も蓄積された材料です。
現在はストレスによって不定胚が誘導されるメカニズムについて、生理学的・形態学的・分子生物学的手法で研究を行っています。
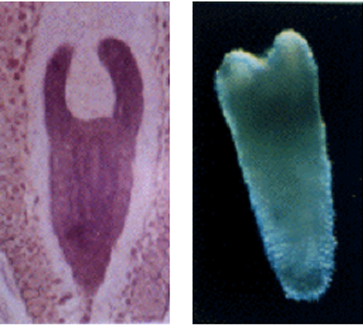
(図)ニンジンの受精胚(左)と不定胚(右)。
不定胚の乾燥耐性と休眠性
種子の乾燥耐性や休眠性は、植物ホルモンの一種であるアブシシン酸(ABA)によって調節されています。一方、不定胚にはABAがほとんど存在せず、乾燥耐性や休眠性はありません。ニンジン不定胚に外部からABAを処理すると、乾燥耐性と休眠性が誘導されました。このように、不定胚ではABA処理(濃度、時間、発達時期など)を操作することで、乾燥耐性や休眠性を人為的に調節できることができます。なお、乾燥した不定胚では含水率5%程度とほぼ完全に水分を失った状態にあり、強い乾燥耐性をもつことがわかります。
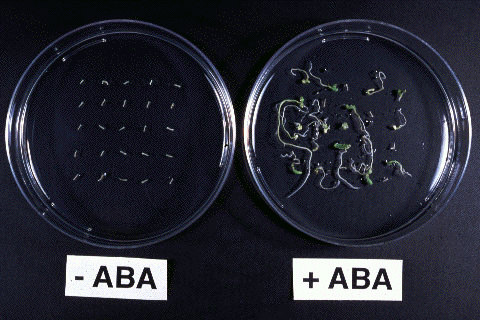 (図)乾燥処理後2週間培養した不定胚(左:ABA未処理、右:ABA処理)。
(図)乾燥処理後2週間培養した不定胚(左:ABA未処理、右:ABA処理)。
ABA応答性遺伝子と発現調節機構
ニンジン不定胚からABA処理で誘導される遺伝子が単離されました。その中には、Late embryogenesis abundant protein (LEAタンパク質)をコードする遺伝子が含まれていました。LEAタンパク質は親水性の高いアミノ酸を多く含むことから、水分子を保持し、細胞から水が失われるのを防ぐはたらきがあると考えられています。これらの遺伝子は、種子や胚でのみ発現するタイプ(ECP31,ECP40,ECP63,CAISE3)、葉でも発現するタイプ(CAISE1,CAISE4,CAISE5)に分類することができました。現在は、これらの遺伝子の機能や発現調節機構を明らかにするため、詳細な発現解析や形質転換植物の解析を行っています。
種子でのABA情報伝達に関わる転写調節因子としては、VP1/ABI3因子が知られています。ニンジンでも類似遺伝子としてC-ABI3が単離されました。C-ABI3を過剰発現させた形質転換植物の研究から、上で示したニンジンのABA誘導性遺伝子(種子や胚でのみ発現するタイプ)の発現が、C-ABI3とABAによって調節されていることが明らかになりました。さらに、ニンジン培養細胞でC-ABI3を過剰発現させた場合には、ABA処理によって複数の遺伝子発現が誘導されるようになり、その結果乾燥耐性が獲得されました。このように、体細胞不定胚においても、VP1/ABI3因子によるABA情報伝達、ABA誘導性遺伝子の発現、乾燥耐性の獲得など、ABAによる一連の反応が受精胚と同じように起きることが明らかになりました。
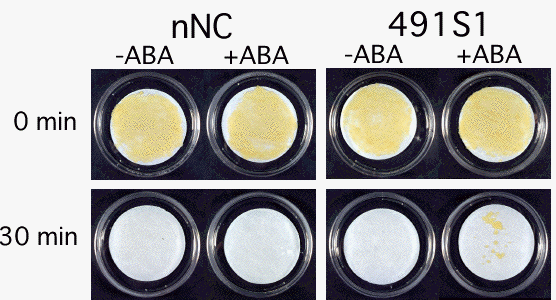 (図)乾燥処理(0分間あるいは30分間)後、3週間培養したニンジン培養細胞。
(図)乾燥処理(0分間あるいは30分間)後、3週間培養したニンジン培養細胞。
nNC:遺伝子導入していない培養細胞、491S1:C-ABI3を過剰発現させた培養細胞、
それぞれABA処理をしたもの(ABA)、しないもの(-ABA)。
アクアポリン(水チャネル)の研究
細胞の内外の水分子の移動では、細胞膜に存在する膜タンパク質(アクアポリン)が選択的に水分子を通過させることが知られています。胚発生でも、胚の発生・成長や休眠・乾燥などに関わるアクアポリンが機能していると考えられ、ニンジン不定胚やトマト種子を使ってアクアポリンの研究を行っています。
トマト種子では、少なくとも6種類の原形質膜アクアポリン(PIP)遺伝子が発現していました。6種類のPIP遺伝子はいずれも種子発達の前半で発現が強く、後半になると弱くなるという共通性が見られました。PIP遺伝子の発現が強い種子発達前期は、種子が水分含有率を低下させる時期と一致していました。これらのことから、トマト種子の水分減少に原形質アクアポリンが関与している可能性が示唆されました。
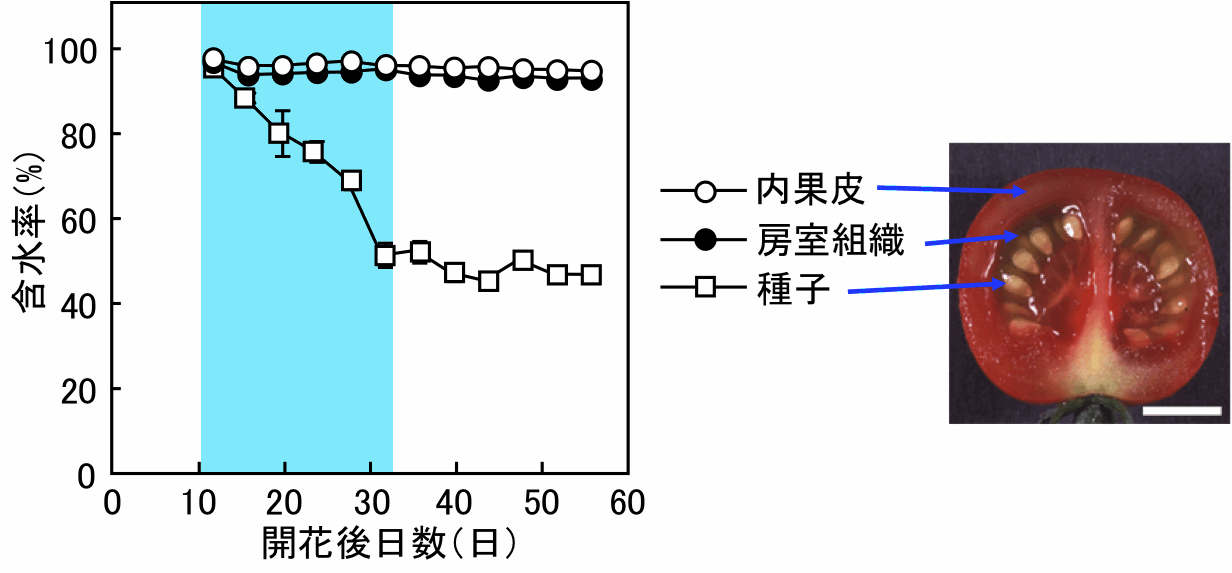 (図)トマト果実と種子の含水率の変化。水色は種子の含水率の変化が大きい期間。
(図)トマト果実と種子の含水率の変化。水色は種子の含水率の変化が大きい期間。
ニンジン不定胚からは、4種類の原形質膜アクアポリン(PIP)遺伝子と2種類の液胞膜アクアポリン(TIP)が単離されました。これらが、胚や種子の発達にどのように関与しているのかを、発現や機能を解析して研究を進めています。
テッポウユリ花粉プロトプラストを利用したアクアポリンの機能解析法を開発しました。テッポウユリ花粉のプロトプラストには、大型(直径0.1 mm)、均質、大量に得られるという利点があります。さらに、ユリ花粉プロトプラストには、原形質膜アクアポリンが発現していないこと、遺伝子導入が可能なことから、アクアポリンの機能解析に適しています。花粉プロトプラストでアクアポリン遺伝子を発現させて低張液に移すと、プロトプラスト内に水が流入しますが、アクアポリンが存在する場合には水の流入(プロトプラストの膨張)が速くなりました。
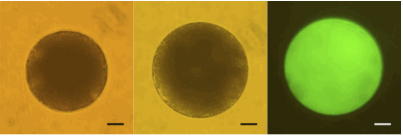 (図)アクアポリン遺伝子を導入したテッポウユリ花粉プロトプラスト。等張液中(左)、低張液中(中)、レポーターの蛍光による遺伝子導入の確認(右)。
(図)アクアポリン遺伝子を導入したテッポウユリ花粉プロトプラスト。等張液中(左)、低張液中(中)、レポーターの蛍光による遺伝子導入の確認(右)。
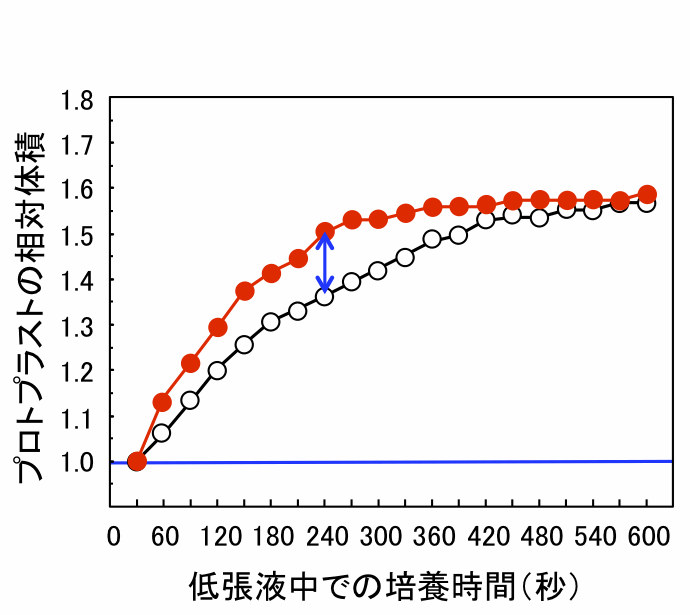
(図)低張液中での花粉プロトプラストの体積変化。アクアポリンを導入した場合(●)は、導入していない場合(○)に比べて体積の増加が速い。
海草(アマモ)の種子の研究
海で生活する植物としては藻類(海藻)が一般的ですが、種子植物(海草)も存在しています。海草は種子植物であるため、陸上の種子植物と同じように種子をつくります。代表的な種がアマモです。アマモは浅い砂地の海底に生育しており、アマモが群生した場所をアマモ場(ば)と呼びます。アマモ場は、光合成能力が高く、また魚介類の生活や繁殖の場としても重要な役割を果たします。しかし、埋め立てや水質汚染のため天然のアマモ場は減少してしまいました。
陸上の種子植物で明らかになった知見を活かして、アマモ種子の発達と発芽、初期成長についても研究を進めています。また、研究活動に関連して、海の環境再生活動にも参加しています。
 (図)アマモの植物体(左)、種子(右)。
(図)アマモの植物体(左)、種子(右)。
社会活動
アマモ場再生活動
金沢八景−東京湾アマモ場再生会議(←http://www.amamo.org/にリンク)による横浜でのアマモ場再生活動に参加しています。H24-H25年度は「地域の文化・歴史と連係したアマモ場再生活動」(横浜市大教員地域貢献活動支援事業)にも取り組みました。関連して、金沢八景近くの琵琶島で水質調査も実施しています。





