研究内容
悪性のがん細胞はコラーゲン等の細胞外マトリックスタンパク質を基質とするタンパク質分解酵素(マトリックスメタロプロテアーゼ, MMPs)を高発現しており、これらの酵素が、がんの浸潤•転移を支えています。私達の研究室ではこれらプロテアーゼの活性発現・調節機構の解明、およびその作用機序を応用したがん転移抑制剤の開発を目標に研究を行っています。
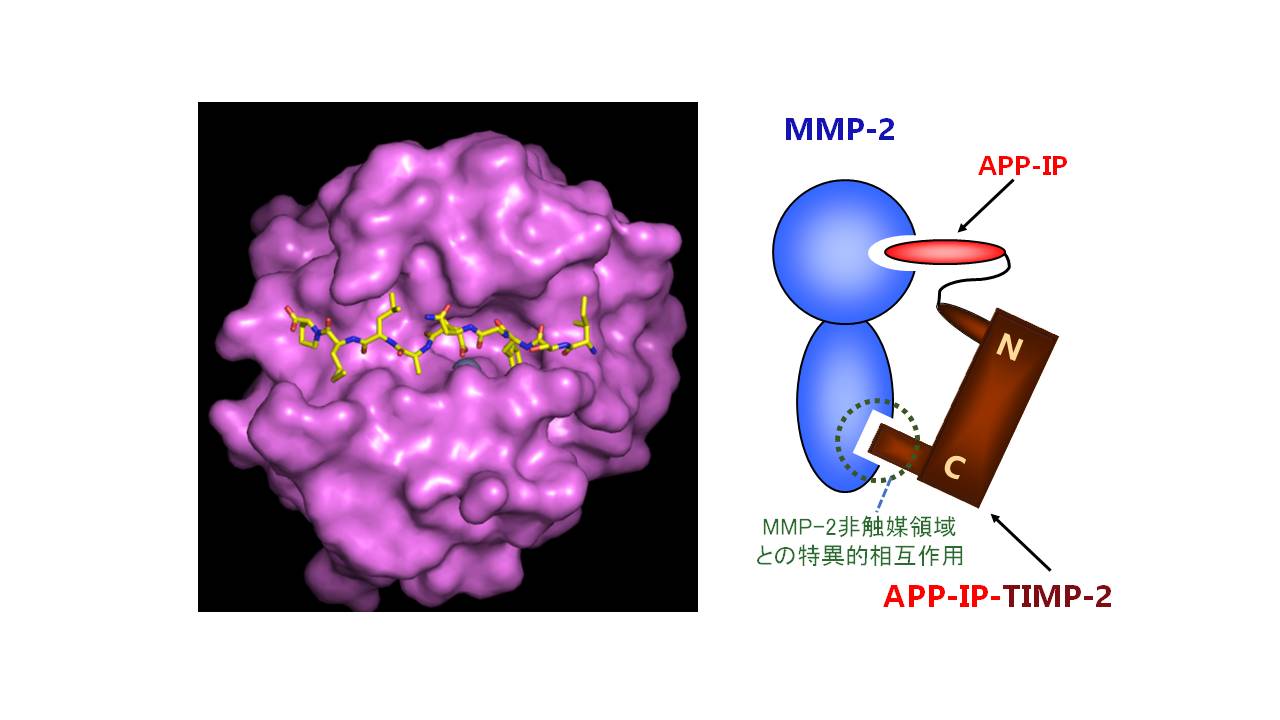
これまでの主な成果として、アルツハイマー病の原因タンパク質として知られるアミロイド前駆体タンパク質 (amyloid precursor protein, APP) の分子内に存在するMMP-2阻害(インヒビター)領域を同定し、10アミノ酸残基からなるペプチド(APP-derived inhibitory peptide, APP-IPと命名)がインヒビター領域を形成することを明らかにしました。APP-IPは従来開発されてきた合成MMPs阻害剤や生体内のインヒビタータンパク質であるtissue inhibitors of metalloproteinases (TIMPs)とは異なり、MMP-2に対し高い選択性を示しました。そこで、タンパク質工学的手法を用い、酵素-インヒビター間の選択的相互作用に関わる構造をアミノ酸残基レベルで明らかにするとともに、APP-IPとMMP-2の複合体の結晶構造を解明することで、APP-IPが従来のメタロプロテアーゼインヒビターとは全く異なる様式でMMP-2と相互作用し、選択性を発揮していることを明らかにしました。
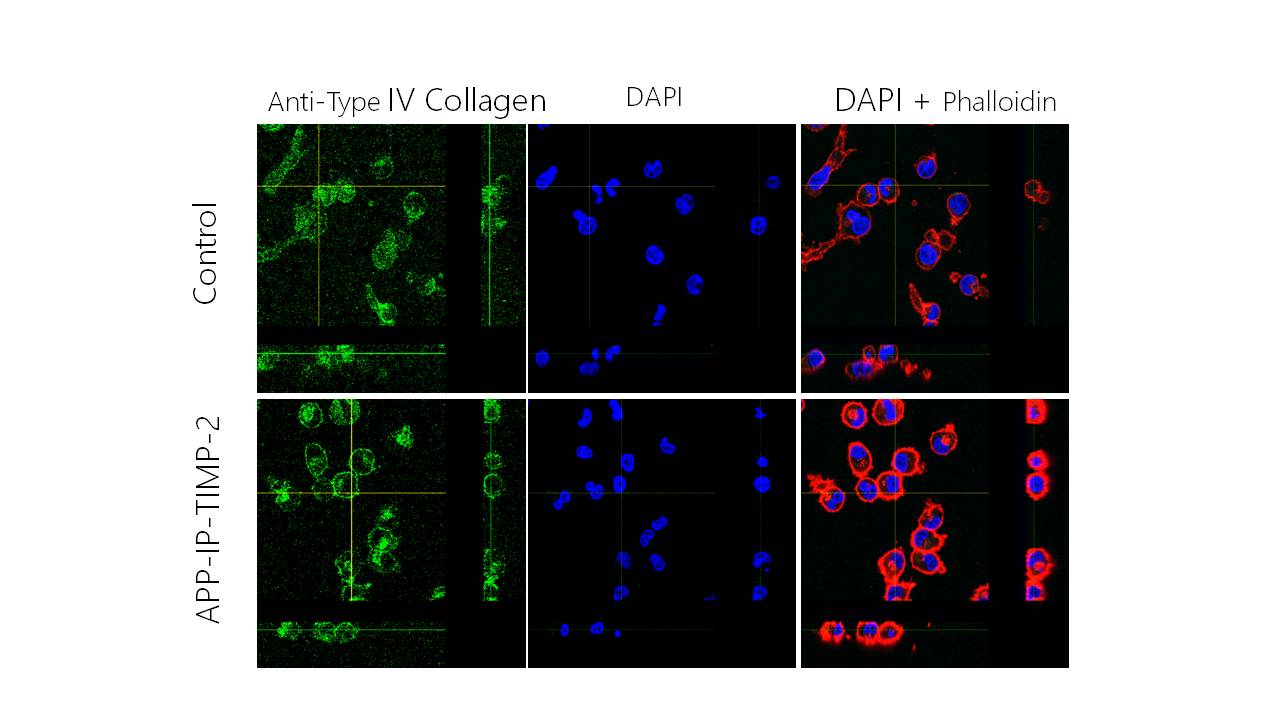
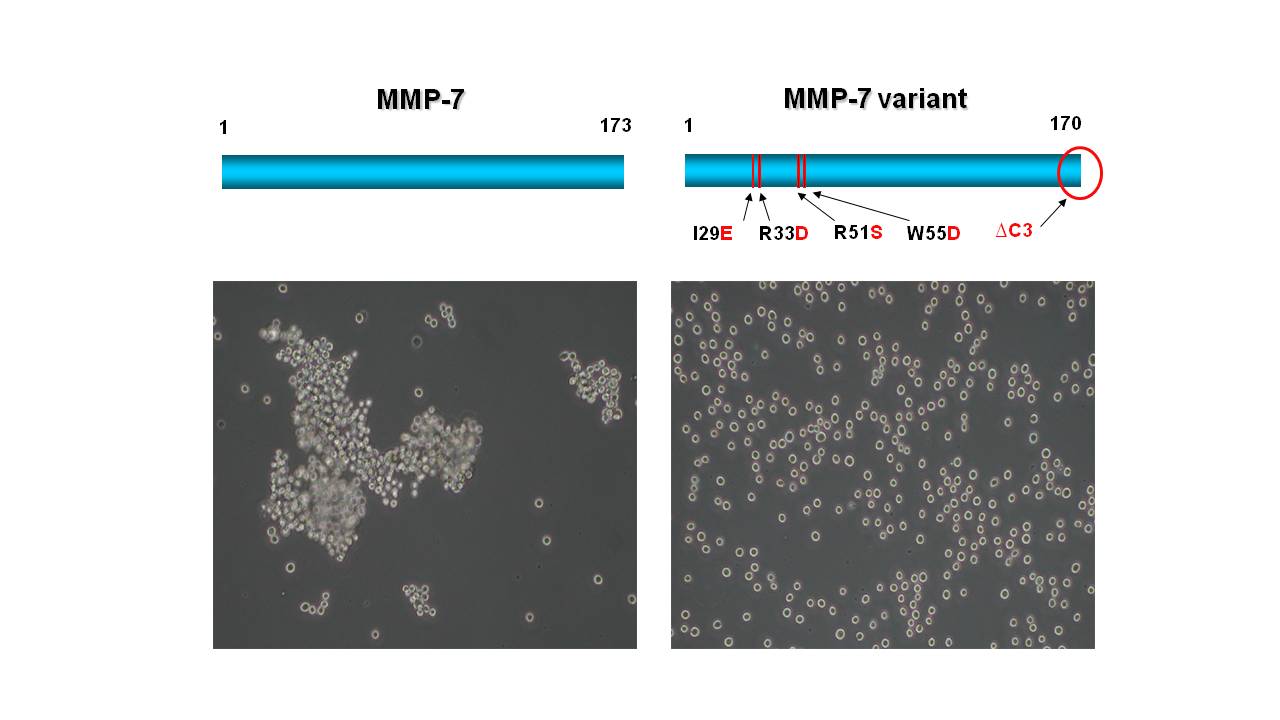
一方、大腸がん等の組織で高発現しているMMP-7は細胞外マトリックスタンパク質の分解だけでなく、種々の受容体タンパク質などの細胞表層タンパク質を切断しつつ、がんの悪性度を高めるという知見が得られています。私たちの研究室では、MMP-7が、がん細胞表層のコレステロール硫酸(CS)に結合することを明らかにし、① CSを介してMMP-7が、がん細胞の細胞膜に結合すると、② 細胞膜タンパク質の切断が促進され、③がん細胞が凝集し、④ がん細胞の転移能が顕著に増強されることを見出しました。現在、MMP-7によるがん細胞の転移能増強機構に介在するタンパク質群の同定を試みるとともに、MMP-7とCSとの相互作用阻害によりがん転移を抑制する方法を模索しています。
がん転移過程における臓器間相互作用の解析
がんが転移する過程において、原発腫瘍が血行性・リンパ行性に遠隔臓器と相互作用し、転移微小環境を形成することが知られています。これにより、遠隔臓器に転移しやすい微小環境が形成されるため、転移臓器に選択性が生じると考えられています(Organotropism)。一方、がんの悪性進展は全身性の症状を引き起こし、それらは臨床的に腫瘍随伴症候群として知られ、特定の臓器と相互作用するという先述の考えとは論理的に矛盾します。そこでがん転移における臓器間相互作用について解析を行い、がん転移の全容解明および新たな治療機会の探索を目的に研究を行っています。



